抗菌伤口敷料能够充当受损皮肤的临时屏障,防止细菌感染,提供有利于伤口愈合的微环境,缩短伤口愈合时间,其广阔的应用前景受到极大关注[1]。然而,传统负载抗生素的抗菌敷料易导致生成耐药细菌,增加治疗难度[2-3]。近些年开发的以纳米银、纳米氧化锌、季铵盐、抗菌肽等作为主要抗菌剂的伤口敷料仍存在着毒性大、成本高等缺陷[4-8]。
卤胺化合物因其杀菌范围广、不易使细菌产生耐药性、毒性小和成本低廉等优势,在近10年被广泛研究。卤胺化合物是指分子结构中含有氮—卤素共价键(N—X,X=Cl、Br或I)的化合物,通常由亚胺、酰胺或胺的卤化过程得到。由于卤胺结构中的卤原子呈现氧化态(+1价),因此其具有抗菌性能[9-10]。Ahmed等[11]通过对聚氨酯的卤化分别制备了带有氯胺、溴胺、碘胺基团的抗菌材料,结果表明氯化、溴化和碘化的聚氨酯对大肠杆菌和金黄色葡萄球菌均具有优异的抗菌性能。Gao等[12]通过两步法制备了溴化抗菌材料,首先通过电化学还原苯胺重氮离子得到聚苯胺膜,然后将膜浸泡在NaBrO溶液中生成溴胺结构。目前卤胺抗菌材料从材料成型到卤化处理的整个制备过程仍存在复杂、费时、使用大量有机溶剂等问题。
不同于传统的聚合方法,电化学技术可被用于快速、可控地制备材料,并赋予功能。Pang等[13]利用电沉积法制备了羟基磷灰石-壳聚糖复合膜,研究表明通过改变电极材料、电沉积条件可以调控复合膜的厚度及组成。Shi等[14]在电沉积壳聚糖的基础上,实现了蛋白在壳聚糖膜上的自组装。首先利用阴极电沉积制备了壳聚糖水凝胶膜;再将带有壳聚糖膜的电极作为阳极,对壳聚糖膜进行“活化”:当施加阳极电压时,电解液中的氯离子得到电子变成氯气,氯气进一步与水反应生成次氯酸;最后强氧化性的次氯酸能够将壳聚糖中的羟基氧化为醛基,醛基可以与蛋白上的伯胺形成希夫碱结构,从而实现蛋白在壳聚糖膜上的自组装。Debiemme-Chouvy等[15]以掺杂锑的二氧化锡电极作为阳极,以含w=0.1%的牛血清白蛋白(BSA)的海水为电解液,实现了抗菌表面的制备,结果表明阳极氧化产生的HClO和HBrO能够与BSA上的氨基反应使蛋白发生聚集,从而生成氯胺和溴胺结构,使电极表面具备优异的抗菌性能。
本文采用电化学两步法快速制备了一种含溴胺结构的自支持壳聚糖抗菌敷料,并对溴化壳聚糖膜的结构、溴胺中的N—Br含量和抗菌性能进行了评价。该方法制备过程简单快速,不添加有机试剂,制备的溴化壳聚糖抗菌敷料具有优异的抗菌性能。
1 实验部分 1.1 材料与仪器壳聚糖:分子量2×105~3×105,75%~85%脱乙酰度,西格玛奥德里奇(上海)贸易有限公司;盐酸、过氧化氢、溴化钠、磷酸氢二钠、磷酸二氢钾、冰乙酸、碘化钾、硫代硫酸钠、w=25%的戊二醛溶液、无水乙醇、乙酸异戊酯:分析纯,上海凌峰化学试剂有限公司;淀粉:分析纯,国药集团化学试剂有限公司;营养肉汤、琼脂粉:生化级,上海博微生物科技有限公司;细菌Live/Dead染色试剂盒:生化级,美国赛默飞世尔科技公司;实验所用大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)均购自中国普通微生物菌种保藏管理中心。
pH计、AL104电子天平:梅特勒托利多国际股份有限公司;GL-21M高速离心机:上海市离心机械研究所;CHI 660E电化学工作站、CHI 115铂丝电极、CHI 111 Ag/AgCl电极:上海辰华仪器有限公司;铂片电极:45 mm×12 mm×2 mm,上海梵越电子科技有限公司;Scientz-10 N冷冻干燥机:宁波新芝生物科技股份有限公司;LDZX-50KBS高压灭菌锅:上海申安医疗器械厂;DHP-9012恒温培养箱:上海一恒科学仪器有限公司;Zeiss LSM激光共聚焦显微镜:日本尼康公司;S4800场发射扫描电子显微镜(SEM)、能谱仪(EDS):日本日立公司;Nicolet 5700型衰减全反射傅里叶变换红外光谱仪(FTIR-ATR):美国热电公司。
1.2 电化学阴极沉积壳聚糖膜(Chit)称取1 g壳聚糖粉末于烧杯中,加入80 mL超纯水,磁力搅拌1 h,待壳聚糖溶胀后滴加1 mol/L的盐酸调节溶液pH至5~6,搅拌过夜,高速离心去除未溶解杂质,取上清液储存于4 ℃冰箱中备用。
取10 mL壳聚糖溶液,加入50 μL H2O2,磁力搅拌均匀。阴极沉积采用三电极体系,以铂片作为工作电极、铂丝作为对电极、Ag/AgCl电极作为参比电极。将三电极浸入与H2O2混合的壳聚糖溶液中,电极与电化学工作站相连,选择恒电流法,在工作电极上施加阴极电流60 mA,沉积时间70 s。沉积完成后将工作电极取出,用超纯水轻轻冲洗电极表面的壳聚糖膜。
1.3 电化学阳极溴化制备溴化壳聚糖膜(Chit-Br)称取适量Na2HPO4·12H2O和KH2PO4溶于超纯水中,调节pH至6.5,配制成0.1 mol/L的磷酸盐缓冲溶液。称取2.06 g NaBr溶于40 mL磷酸盐缓冲溶液中,配制成含0.5 mol/L NaBr的磷酸盐缓冲液,作为阳极溴化电解液。
将对电极和参比电极用超纯水冲洗干净,与带有壳聚糖膜的工作电极一同浸入电解液中,和电化学工作站连接,选择计时库仑法,设置起始电压3 V,终止电压3 V,进行阳极溴化,至阳极电量分别达到4、8、14、18.4、20.5 C时,得到不同溴化程度的壳聚糖膜。用镊子将溴化壳聚糖膜从电极上轻轻剥离,超纯水多次洗涤,冷冻干燥。
1.4 Chit与Chit-Br的表征采用场发射扫描电子显微镜和能谱仪表征样品表面形貌及结构,喷金40 s,电压10 kV;利用衰减全反射傅里叶变换红外光谱仪表征样品结构,测定波数为2 000~600 cm-1。
用碘量滴定法测定N—Br含量:将Chit和Chit-Br用超纯水反复冲洗,剪成小块,溶于38 mL醋酸溶液(w=1%)中,氮气气氛下,加入1 g KI和2 mL淀粉溶液(w=1%),在磁力搅拌器上剧烈搅拌1 h;称取0.124 g Na2S2O3溶于50 mL超纯水中配制成0.1 mol/L的Na2S2O3溶液,利用Na2S2O3溶液对形成的单质碘进行滴定,当溶液从蓝色变为无色时,停止滴定,记录消耗的Na2S2O3溶液的体积[18]。
1.5 Chit和Chit-Br的抗菌性能评价 1.5.1 平板计数法抗菌实验将大肠杆菌和金黄色葡萄球菌分别作为革兰氏阴性菌模型和革兰氏阳性菌模型。用生理盐水将菌液梯度稀释至约107 CFU/mL,24孔板每孔加入1 mL菌液和Chit或Chit-Br,以只加入1 mL菌液的样品为空白对照,放入37 ℃恒温培养箱内共培养12 h。用生理盐水将共培养菌液梯度稀释,取100 μL菌液滴在固体琼脂平板上,轻轻震荡使菌液均匀铺满平板,将平板放入37 ℃恒温培养箱内培养15 h,记录形成的菌落数,计算杀菌率,实验的每组样品均设置3个平行样。
1.5.2 抑菌圈实验用打孔器将Chit和Chit-Br制成直径为0.8 cm的圆片。取200 μL, 106 CFU/mL的菌液滴在固体琼脂平板上,轻轻震荡使菌液均匀铺满平板,将Chit和Chit-Br圆片分别置于平板上,放入37 ℃恒温培养箱内培养12 h,将平板翻转底部向上,观察记录抑菌圈的形成情况。
1.5.3 细菌的形貌表征将空白对照组菌液和与Chit-Br共培养12 h的菌液(1 mL)高速离心,去除500 μL上清液,加入1 mL戊二醛溶液(w=2.5%),静置2~3 h。高速离心5 min,去除部分上清液,加入1 mL酒精(φ=30%),静置10 min后再高速离心5 min,依次用φ为50%、75%、85%、90%和100%的酒精进行梯度脱水10 min,最后加入乙酸异戊酯置换酒精。将脱水后的菌液滴在硅片上,放入冷冻干燥机中冻干24 h。将硅片黏在导电胶上,喷金40 s,电压10.0 kV,通过SEM观察细菌形貌。
1.5.4 细菌死活染色避光条件下,向空白对照组菌液和与Chit-Br共培养12 h的菌液中分别加入Live/Dead染料,在37 ℃恒温培养箱内培养10~15 min,将菌液滴在盖玻片上均匀铺开,通过激光共聚焦显微镜(CLSM)观察细菌染色情况。激发波长为488 nm和543 nm,采用20倍水镜进行观察。
2 结果与讨论 2.1 Chit与Chit-Br的电化学制备及表面形貌利用壳聚糖溶解度的pH响应性[16],当在工作电极上施加阴极电流时,阴极的H+ 会得到电子变成H2逸出,使阴极表面附近的局部pH升高,阴极与电解液间形成pH梯度,壳聚糖链氨基上的正电荷被中和。当pH高于壳聚糖的酸度系数(pKa) 6.3时,壳聚糖从酸性溶液中析出,分子链相互缠绕,实现溶胶-凝胶转变,在阴极表面形成壳聚糖水凝胶膜。在阴极沉积前,向壳聚糖溶液中加入H2O2,可使H2O2替代H+在阴极发生还原反应,形成pH梯度,避免水凝胶膜内产生H2气泡。
阳极溴化的机理如反应式(1~3)所示[15]。以含0.5 mol/L NaBr的磷酸盐缓冲溶液(pH=6.5)为电解液,当在工作电极上施加阳极电压时,Br-失去电子变成Br2逸出,Br2与水反应生成HBrO。具有强氧化性的HBrO能够与壳聚糖的伯胺或酰胺反应生成溴胺结构,从而形成Chit-Br。
| $ 2{\rm{B}}{{\rm{r}}^-} \to {\rm{B}}{{\rm{r}}_2} + 2{{\rm{e}}^-} $ | (1) |
| $ {\rm{B}}{{\rm{r}}_2} + {{\rm{H}}_2}{\rm{O}} \to {\rm{HBrO + B}}{{\rm{r}}^-} + {{\rm{H}}^ + } $ | (2) |
| $ {\rm{N}}-{\rm{H + HBrO}} \to {\rm{N}}-{\rm{Br}} + {{\rm{H}}_2}{\rm{O}} $ | (3) |
图 1为Chit和Chit-Br的数码照片及扫描电镜照片。如图 1所示,阴极沉积的Chit呈透明、无褶皱结构,表面存在小气泡。经过阳极溴化,Chit-Br呈浅黄色,表面出现许多褶皱,膜表面形貌发生变化的原因可能是溴化过程中HBrO的氧化造成壳聚糖的刻蚀。

|
图 1 Chit (a)和Chit-Br (b)的表面SEM图片及数码照片(插图) Fig. 1 Surface SEM images and digital photographs (insert) of Chit (a) and Chit-Br (b) |
2.2 Chit与Chit-Br的化学结构表征
Chit和Chit-Br的EDS谱图如图 2所示。Chit中只有C、N、O这3种元素,而Chit-Br出现了Br元素的信号峰,且未出现Na的信号峰(1 keV),表明Chit-Br中无残留NaBr,所检测到的Br是与N共价结合的,即成功实现了壳聚糖溴化[15]。
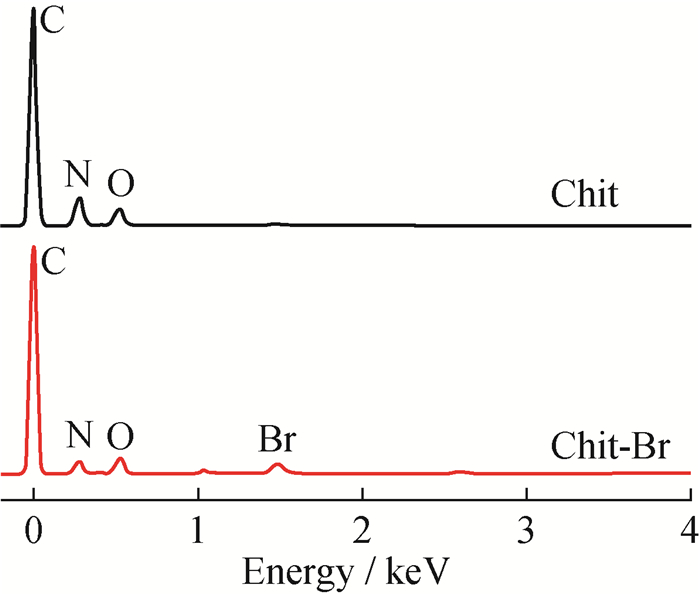
|
图 2 Chit和Chit-Br的EDS谱图 Fig. 2 EDS spectra of Chit and Chit-Br |
Chit和Chit-Br的红外谱图如图 3所示。Chit具有酰胺Ⅰ带(C═O伸缩振动,1 647 cm-1)、酰胺Ⅱ带(N—H弯曲振动,1 559 cm-1)、酰胺Ⅲ带(C—N伸缩振动,1 314 cm-1)、糖苷键(C—O—C非对称伸缩振动,1 150 cm-1)、C3—OH(1 059 cm-1)、C6—OH(1 026 cm-1)和β-D构型峰(894 cm-1)等壳聚糖分子的特征吸收峰。与Chit相比,Chit-Br谱图中羰基C=O伸缩振动峰向低波数方向移动,可能是由于卤化过程中N—H键转变为N—Br键,破坏了分子间氢键N—H…O═C,从而影响C═O的振动频率。Chit-Br位于1 150 cm-1处的1, 4-糖苷键C—O—C不对称伸缩振动峰和900 cm-1处的β-D构型峰的强度均明显减弱,表明在壳聚糖溴化的过程中,分子链发生了断裂,导致糖结构单元的损失[17]。
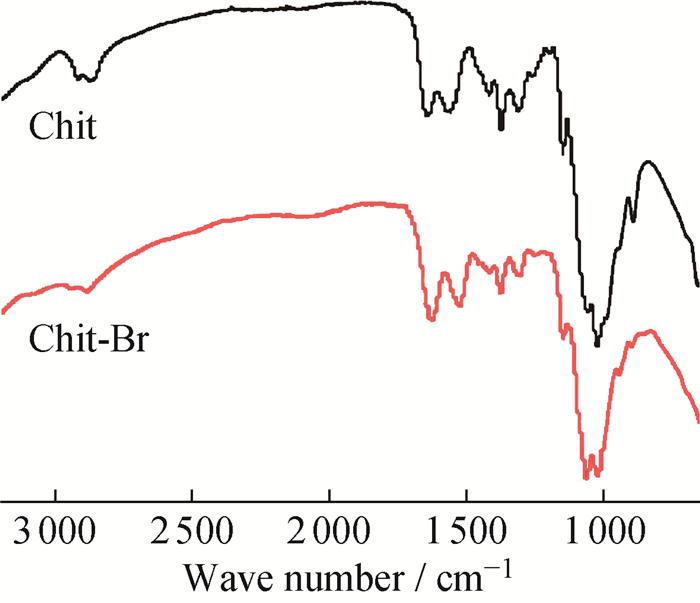
|
图 3 Chit和Chit-Br的FTIR-ATR谱图 Fig. 3 FTIR-ATR spectra of Chit and Chit-Br |
2.3 碘量滴定法定量表征Chit-Br中N—Br的含量
参照文献[18],N—Br能够将I-氧化为与淀粉发生显色反应的I2,使溶液变为蓝色,通过滴加硫代硫酸钠溶液将形成的碘单质还原,溶液变成无色时为滴定终点。实验过程中观察到,N2气氛下Chit不能将KI氧化为I2,溶液呈无色。向Chit-Br的醋酸溶液中加入KI和淀粉后,溶液迅速变为蓝紫色,说明有单质碘生成。剧烈搅拌1 h令反应充分,再逐滴滴加硫代硫酸钠溶液,将I2还原至溶液呈无色。根据反应方程式(4~5),通过消耗的硫代硫酸钠溶液的体积可推算出N—Br的物质的量,从而得到单位面积上的N—Br含量。采用不同阳极电量制备的Chit-Br的N—Br含量如图 4所示。由图 4可以看出,当阳极电量为4.0~20.5 C时,Chit-Br中的N—Br含量无显著差异。本文选用8.0 C阳极电量作为Chit-Br的代表用于抗菌实验。
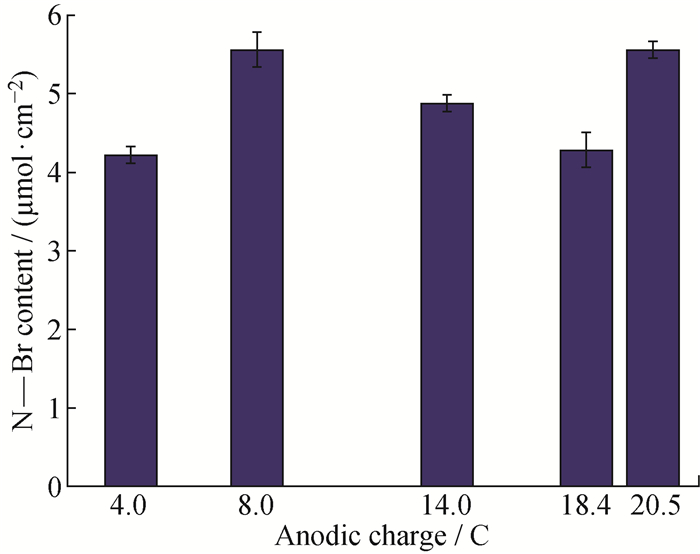
|
图 4 不同阳极电量制备的Chit-Br中的N—Br含量 Fig. 4 N—Br contents of Chit-Br brominated using different anodic charges |
| $ {\rm{N}}-{\rm{Br}} + 2{{\rm{I}}^-} + {{\rm{H}}^ + } \to {\rm{N}}-{\rm{H}} + {{\rm{I}}_2} + {\rm{B}}{{\rm{r}}^ - } $ | (4) |
| $ {{\rm{I}}_2} + 2{{\rm{S}}_2}{{\rm{O}}_3}^{2-} \to 2{{\rm{I}}^-} + {{\rm{S}}_4}{{\rm{O}}_6}^{2-} $ | (5) |
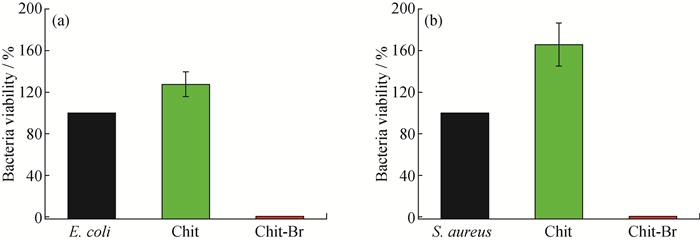
与Chit和Chit-Br共培养12 h后的细菌生长情况如图 5所示。将图 5中的菌落数转换为细菌存活率柱状图(图 6)可以看出,Chit膜不仅不能抑制细菌的生长,反而促进细菌的增殖。原因可能是在细菌培养的过程中,壳聚糖作为营养物质被消耗;而Chit-Br的杀菌率高达100%,具有优异的抗菌性能,有望作为非抗生素型抗菌敷料,用于处理感染伤口。
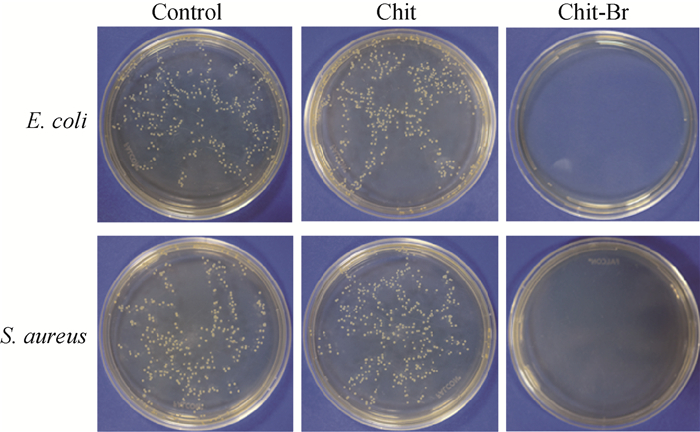
|
图 5 与Chit和Chit-Br共培养后细菌的生长情况 Fig. 5 Colony formation of bacteria after treatment of Chit and Chit-Br |
|
Black column: Blank bacteria; Green column: Bacteria after treatment of Chit; Red column: Bacteria after treatment of Chit-Br 图 6 与Chit和Chit-Br共培养后E.coli (a)及S.aureus (b)的存活率柱状图 Fig. 6 Viability histogram of E.coli (a) and S.aureus (b) after treatment of Chit and Chit-Br |
2.4.2 抑菌圈实验
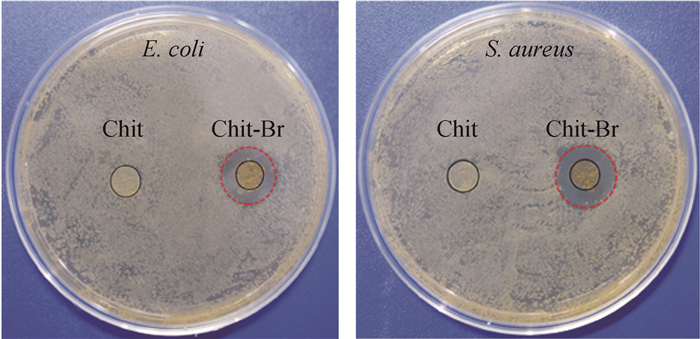
Chit和Chit-Br的抑菌圈图片如图 7所示。Chit对E. coli和S.aureus都未表现出抑菌圈,而Chit-Br周围出现了明显的抑菌圈,说明Chit-Br的抗菌性能显著优于Chit,并且在Chit-Br抗菌过程中,有Br+从膜中扩散出来发挥杀菌作用,与文献报道的释放杀菌机理一致[19]。
|
图 7 Chit和Chit-Br的抑菌圈图片 Fig. 7 Inhibition zones images of Chit and Chit-Br against bacteria |
2.4.3 细菌的形貌表征
图 8为Chit-Br处理前后细菌的SEM图片。如图所示,在与Chit-Br共培养前,两种细菌均具有分明的轮廓边缘,E. coli呈完整棒状,S.aureus呈规则球状,两者表面均完整光滑。然而在与Chit-Br共培养12 h后,细菌原始形貌被破坏,细胞发生收缩,表面变得粗糙、高低不平。表明Chit-Br具有优异的杀菌性能,N—Br能够破坏细菌表面结构,导致细菌死亡,与N—Cl和HClO的抗菌机理类似[20-21]。

|
图 8 Chit-Br处理前后细菌的SEM图片 Fig. 8 SEM images of bacteria before and after treatment of Chit-Br |
2.4.4 细菌死活染色
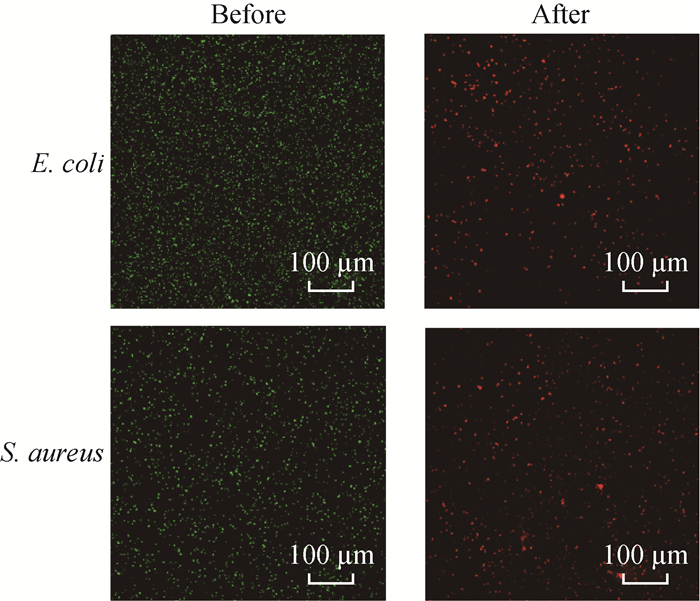
Chit-Br处理前后细菌的荧光染色情况如图 9所示。由图 9可以看出,经过与Chit-Br共培养后,E. coli和S.aureus几乎全部被杀死,表明Chit-Br具有强大的杀菌能力,与共培养和抑菌圈实验结果一致。
|
Green: Live bacteria; Red: Dead bacteria 图 9 Chit-Br处理前后细菌的荧光染色图片 Fig. 9 Fluorescent staining images of bacteria before and after treatment of Chit-Br |
3 结论
(1) 采用电化学两步法制备了自支持溴化壳聚糖抗菌敷料,制备过程简单快速、不加入有机试剂,为抗菌伤口敷料的设计和制备提供了新策略。
(2) 壳聚糖可通过电极反应原位生成溴化试剂而被溴化,溴化过程同时伴随着对糖单元的氧化。
(3) 当阳极电量为4.0~20.5 C时,所制备的Chit-Br中的N—Br含量无显著差异。
(4) Chit-Br对大肠杆菌和金黄色葡萄球菌的杀菌率均高达100%,能够通过破坏细菌表面结构导致细菌死亡。
| [1] | 程惠蕾, 周雯婷, 郑安呐, 等. 抗菌水凝胶敷料的制备及性能[J]. 功能高分子学报, 2014, 27(3): 315–320. |
| [2] | ANJUM S, ARORA A, AlAM M S, et al. Development of antimicrobial and scar preventive chitosan hydrogel wound dressings[J]. International Journal of Pharmaceutics, 2016, 508(1-2): 92–101. DOI:10.1016/j.ijpharm.2016.05.013 |
| [3] | JIANG Shuai, MA B C, REINHOLZ J, et al. Efficient nanofibrous membranes for antibacterial wound dressing and UV protection[J]. ACS Applied Materials & Interfaces, 2016, 8(44): 29915–29922. |
| [4] | LIANG Donghui, LU Zhong, YANG Hao, et al. A novel asymmetric wettable AgNPs/Chitosan wound dressing:In vitro and in vivo evaluation[J]. ACS Applied Materials & Interfaces, 2016, 8(6): 3958–3968. |
| [5] | LEVIPOLYACHENKO N, JACOB R, DAY C, et al. Chitosan wound dressing with hexagonal silver nanoparticles for hyperthermia and enhanced delivery of small molecules[J]. Colloids & Surfaces B Biointerfaces, 2016, 142: 315–324. |
| [6] | KUMAR P T, LAKSHMANAN V K, ANILKUMAR T V, et al. Flexible and microporous chitosan hydrogel/nano ZnO composite bandages for wound dressing:In vitro and in vivo evaluation[J]. ACS Applied Materials & Interfaces, 2012, 4(5): 2618–2629. |
| [7] | YU Qian, SONG Yanan, SHI Xiaomei, et al. Preparation and properties of chitosan derivative/poly(vinyl alcohol) blend film crosslinked with glutaraldehyde[J]. Carbohydrate Polymers, 2011, 84(1): 465–470. DOI:10.1016/j.carbpol.2010.12.006 |
| [8] | SONG D W, KIM S H, KIM H H, et al. Multi-biofunction of antimicrobial peptide-immobilized silk fibroin nanofiber membrane:Implications for wound healing[J]. Acta Biomaterialia, 2016, 39: 146–155. DOI:10.1016/j.actbio.2016.05.008 |
| [9] | HUI F, DEBIEMMECHOUVY C. Antimicrobial N-halamine polymers and coatings:A review of their synthesis, characterization, and applications[J]. Biomacromolecules, 2013, 14(3): 585–601. DOI:10.1021/bm301980q |
| [10] | DONG Alideertu, WANG Yanjie J, GAO Yangyang, et al. Chemical insights into antibacterial N-halamines[J]. Chemical Reviews, 2017, 117(6): 4806–4862. DOI:10.1021/acs.chemrev.6b00687 |
| [11] | AHMED E S I, HAY J N, BUSHELL M E, et al. Biocidal polymers (Ⅱ):Determination of biological activity of novel N-halamine biocidal polymers and evaluation for use in water filters[J]. Reactive & Functional Polymers, 2008, 68(10): 1448–1458. |
| [12] | GAO Shan, CACHET H, DEBIEMME-CHOUVY C. N-halamine coatings formed via the electroreduction of in situ generated diazonium cations:Toward antimicrobial surfaces[J]. Surface & Interface Analysis, 2016, 48(7): 630–635. |
| [13] | PANG Xin, ZHITOMIRSKY I. Electrodeposition of composite hydroxyapatite-chitosan films[J]. Materials Chemistry & Physics, 2005, 94(2-3): 245–251. |
| [14] | SHI Xiaowen, YANG Xiaohua, GASKELL K J, et al. Reagentless protein assembly triggered by localized electrical signals[J]. Advanced Materials, 2009, 21(9): 984–988. DOI:10.1002/adma.v21:9 |
| [15] | DEBIEMME-CHOUVY C, HUA Y, HUI F, et al. Electrochemical treatments using tin oxide anode to prevent biofouling[J]. Electrochimica Acta, 2011, 56(28): 10364–10370. DOI:10.1016/j.electacta.2011.03.025 |
| [16] | ROHAN FERNANDES, WU Liqun, CHEN Tianhong, et al. Electrochemically induced deposition of a polysaccharide hydrogel onto a patterned surface[J]. Langmuir, 2003, 19(10): 4058–4062. DOI:10.1021/la027052h |
| [17] | DONG Alideertu, HUANG Jinfeng, LAN Shi, et al. Synthesis of N-halamine-functionalized silica-polymer core-shell nanoparticles and their enhanced antibacterial activity[J]. Nanotechnology, 2011, 22(29): 295602. DOI:10.1088/0957-4484/22/29/295602 |
| [18] | LI Chenghao, XUE Linyan, CAI Qian, et al. Design, synthesis and biocidal effect of novel amine N-halamine microspheres based on 2, 2, 6, 6-tetramethyl-4-piperidinol as promising antibacterial agents[J]. RSC Advances, 2014, 4(88): 47853–47864. DOI:10.1039/C4RA08443H |
| [19] | GUTMAN O, NATAN M, BANIN E, et al. Characterization and antibacterial properties of N-halamine-derivatized cross-linked polymethacrylamide nanoparticles[J]. Biomaterials, 2014, 35(19): 5079–5087. DOI:10.1016/j.biomaterials.2014.02.056 |
| [20] | LI Chenghao, HOU Jingjing, HUANG Zhen, et al. Assessment of 2, 2, 6, 6-tetramethyl-4-piperidinol-based amine N-halamine-labeled silica nanoparticles as potent antibiotics for deactivating bacteria[J]. Colloids & Surfaces B Biointerfaces, 2015, 126: 106–114. |
| [21] | CAI Qian, BAO Sarina, ZHAO Yue, et al. Tailored synthesis of amine N-halamine copolymerized polystyrene with capability of killing bacteria[J]. Journal of Colloid & Interface Science, 2015, 444: 1–9. |
 2018, Vol. 31
2018, Vol. 31


