聚合物太阳能电池(PSCs)具有材料来源广泛、质量轻、可柔性制备大面积器件等优势,在便携式电子充电装置、可穿戴电子服饰、光伏建筑一体化等领域具有很强的应用潜力,已成为绿色清洁能源太阳能利用技术的重要研究领域[1-3]。目前,提升PSCs的能量转化效率(PCE)依然是当前研究的重心,借助调控活性层材料的分子结构和优化器件制备工艺等可显著提升电池性能[4-6];但优化器件制备工艺的过程过于繁琐,且影响因素复杂、复现性差,而对材料的结构进行设计和调控则相对更易于操作和实现。研究表明,构建给体-π桥-受体(D-π-A)型共聚物是获得高效PSCs材料的有效方法之一[7-8]。
构建D-π-A型共聚物主链的π桥一方面连接着D和A单元,另一方面又影响着分子内的电荷分离程度。通常用作π桥的单元包括:噻吩(T)、轴对称的联二噻吩(2T)、中心对称的稠合噻并[3, 2-b]噻吩(TT)、呋喃(F)和硒酚等[9-15]。2012年北京化工大学的王海侨和中科院化学所李永舫[9]设计了一系列以F、T和TT作π桥的共聚物P(BDT-F-BT)、P(BDT-T-BT)和P(BDT-TT-BT),研究表明,当π桥由T到F再到TT,分子链的构型由Zigzag型变为线型,光学带隙(Egopt)从1.96 eV降至1.82 eV再到1.78 eV,最高分子占有轨道能级(EHOMO)从-5.44 eV升高至-5.35 eV再到-5.21 eV,基于它们与PC71BM的电池器件的开路电压(UOC)从0.94 V减小至0.82 V再到0.69 V,短路电流密度(JSC)从6.50 mA/cm2到9.45 mA/cm2再到11.34 mA/cm2和填充因子(FF)从46%到48%再到63%,均呈增加趋势,最终TT桥的P(BDT-TT-BT)基电池的PCE分别高出呋喃桥的P(BDT-F-BT)的75%、高出噻吩桥的P(BDT-T-BT)的33%。2014年,韩国国立釜山大学的Kim等[10]设计并制备了含噻吩和6-烷基噻并[3, 2-b]噻吩π桥的一维PBDT-TPD、PBDT-ttTPD和二维的PBDTT-TPD、PBDTT-ttTPD,研究表明含烷基噻并[3, 2-b]噻吩π桥聚合物的结晶性和空穴迁移率增强,其与PC71BM倒置器件的JSC、FF和PCE也显著提高。同年,美国华盛顿大学的Jen等[11]报道了基于印达生并二噻并[3, 2-b]噻吩(IDTT)与氟代苯并噻二唑且含T与TT不同π桥的共聚物PIDTT-DFBT-T和PIDTT-DFBT-TT,虽然π桥调节对EHOMO无影响且使Egopt增大,但π桥TT使聚合物短波处的吸收峰增强、空穴迁移率提高,最终取得了7.2%的PCE,相同条件下噻吩桥的PCE仅为4.4%。T和TT除了用作π桥连接D和A,也被广泛用作富电子单元构建D-π-A型共聚物,并表现出优异的光电性能调节能力[4, 8]。2017年华南理工大学陈军武等[8]报道了T和TT作给电子单元的FBT基窄带隙共聚物FBT-DThDT-1T和FBT-DThDT-TT,研究表明用TT替代T,最大吸收峰红移,光学带隙从1.62 eV减小到1.57 eV,薄膜状态下的摩尔消光系数增加,聚合物链间聚集作用增强,从而大幅度提高了迁移率,最终TT基和T基电池的PCE依次为7.34%和0.92%。最近,本课题组[4]研究了寡聚噻吩-萘并[1, 2-c:5, 6-c′]双[1, 2, 5]噻二唑(NT)基窄带隙共聚物体系,与明星材料PNTz4T作对比,将D-π-A共聚物结构中的D单元从2T调节为T和TT,研究表明用TT替代T材料,吸收光谱红移、摩尔消光系数增加、EHOMO下降,材料的分子平面性和线性程度改善,空间电荷限制电流(SCLC)型空穴迁移率也从2.47×10-5 cm2/(V·s)增加到7.75×10-5 cm2/(V·s),最终最优条件下的倒置型光伏器件的PCE分别为5.10%和6.88%。不难看出,无论用作D-π-A型共聚物中的π桥还是D单元,具有更大共轭面和更长共轭长度的TT均表现出了优异的光电性能。
近年来,通过在聚合物骨架上引入氟取代基实现对聚合物光伏性能改进的研究屡见报道,在调节材料结构、光敏活性层微观形貌和器件特性方面已被证实是一种简单且易于实现的方法。由于氟原子的范德华半径小、电负性强,所以氟引入可在不明显增大空间位阻情况下实现对分子电荷分布及其能级的有效调控。除此之外,氟引入共聚物体系会产生C—F…H、C—F…S和C—F…N等非共价键作用力,从而利用其分子内或分子间的相互作用力实现对材料的分子平面性和结晶有序性的调节[16-20]。Ding等[21]在苯并[1, 2-b:4, 5-b′]二噻吩(BDT)与苯并噻二唑(BT)的窄带隙聚合物体系中引入氟原子,研究表明氟取代对材料的吸收光谱影响小,溶解性下降,虽然EHOMO降低了0.18 eV,但对应器件的UOC并未升高,而JSC和FF明显提高,从而使PCE从1.88%提高到3.40%。2012年,Neher等[22]设计了环戊并二噻吩(CPDT)基的共聚物PCPDTBT和F-PCPDTBT,研究表明在BT上引入单氟后可明显降低EHOMO,使UOC提高0.13 V,并明显抑制了孪生复合和非孪生复合,从而使FF提高了8%、JSC提高了2.2%。引入氟原子除了可明显降低EHOMO外,Jen等[23]的研究也表明氟原子的引入可明显改善堆积,进而使迁移率翻倍并优化活性层形貌,使电池的PCE从2.75%提高到5.81%。而在含TT共轭侧基的二维BDT基共聚物体系中,Wong等[24]的研究表明在BT上引入氟后带隙减小,同时EHOMO下移,SCLC型空穴迁移率降低且活性层形貌变差,从而制得了PCE仅为1.2%的电池器件。除了在A单元上引入氟原子进行调节外,在D单元上引入氟原子亦非常有效。2015年,颜河等[25]在氟代BTA基共聚物的给电子单元联二噻吩上引入氟后,材料的吸收光谱稍微红移、EHOMO下移,氟效应使聚合物在溶液状态出现强的J-聚集(由分子错位平行堆积所形成),从而增强了聚合物结晶性和空穴迁移率,使电池的PCE从2.8%显著提高到7.8%。2016年,日本广岛大学的Takimiya等[26]研究了NT-寡聚噻吩共聚物体系上富电子2T上的氟取代效应,通过调节富电子单元2T上的氟原子个数制备了PNTz4TF2、PNTz4TF4和对照物PNTz4T,研究表明随着氟原子数目增加,材料溶解性变差、带隙增加,虽然EHOMO下降使得器件的UOC从0.71 V增加到0.82 V再到0.93 V,增加的氟取代基明显加重了双分子复合,使器件的FF下降,不含氟的PNTz4T和含2个氟的PNTz4TF2的PCE分别为10.2%和10.5%,而含4个氟的PNTz4TF4的PCE仅6.5%。2017年韩国加图立大学的Kang等[27]考察在二维宽带隙共聚物的给电子单元BDT上的氟效应,研究表明引入氟后带隙增大、EHOMO降低,从而大幅度提高了器件的UOC,使PCE从6.79%增至7.45%。You等[28]进一步拓展研究思路,将氟原子转移至受体BTA两侧的噻吩π桥上,研究表明氟原子位于4′位上的4′-FT-FTAZ基的PCE最佳,可达到7.74%。可见氟取代的方法在调节材料结构和光电性能方面是一种非常有效且易于实现的策略。
基于噻并[3, 2-b]噻吩用作π桥和氟取代在调节材料结构方面所表现的优异光电性能,本文选择烷基噻并[3,2-b]噻吩作侧基、BDT为富电子单元、噻并[3, 2-b]噻吩作π共轭桥、苯并[d][1, 2, 3]三氮唑(BTA)/5, 6-二氟苯并[d][1, 2, 3]三氮唑(FBTA)作缺电子单元,设计并制备了宽带隙共聚物PTTBDT-BTA和PTTBDT-FBTA。为了确保增大共轭面的共聚物具有足够的溶液加工性,在BTA和FBTA上均键接入2-癸基十四烷基柔性侧链。系统研究了氟引入对聚合物的溶解性、热稳定性、吸收光谱、溶液状态聚集行为、薄膜态光稳定性和光伏性能的影响,研究结果表明氟取代使对应电池的PCE提高了49.3%。
1 实验部分 1.1 试剂与仪器实验中所用试剂除特别说明外,全部购自百灵威科技有限公司、Acros公司、上海TCI有限公司和Aldrich化学试剂公司,依照规范的溶剂处理方法对实验所用溶剂进行了进一步的提纯。双锡化合物2, 6-双(三甲基锡基)-4, 8-双[5-(2-丁基辛基)噻并[3, 2-b]噻吩-2-基]苯并[1, 2-b:4, 5-b′]二噻吩(TTBDTSn)[29]、二溴物4, 7-二溴-2-(2-癸基十四烷基)苯并[d][1, 2, 3]三氮唑(BTABr2)[30]和4, 7-二溴-2-(2-癸基十四烷基)-5, 6-二氟苯并[d][1, 2, 3]三氮唑(FBTABr2)[20]、2-三(正丁基锡基)噻并[3, 2-b]噻吩(TTSnBu3)[31]和共轭聚电解质聚[9, 9-双(3′-(N, N-二甲氨基)丙基-2, 7-芴-alt-2, 7-(9, 9-二辛基芴)](PFN)[32]均按照文献报道的方法合成,并在使用前经1H-NMR分析。
1H-NMR和13C-NMR在德国Bruker DRX 400核磁共振仪上测定;熔点使用北京泰克仪器有限公司X-4数字显示显微熔点测定仪测定,测试过程中温度计未经校正;高分辨质谱(HRMS)在美国Therm Electron公司傅里叶变换质谱仪上测定;元素分析用德国Elementer Analysencysteme Gmbh Vario EL元素分析仪测定;聚合物的数均分子量(Mn)、重均分子量(Mw)和分散系数(PDI)用美国Waters GPC 2410仪器测试;热稳定性使用美国TGA2050热重分析仪测试;使用日本岛津UV1800紫外分析仪测得聚合物的紫外-可见(UV-Vis)吸收光谱;聚合物的电化学循环伏安(CV)曲线用上海辰华仪器有限公司CHI600D电化学工作站测得,采用三电极体系,使用0.1 mol/L的Bu4NPF6的乙腈溶液为电解质,滴涂待测聚合物的氯苯溶液至铂碳电极上,待其成膜后作工作电极,Ag/AgNO3作参比电极,铂丝作辅助电极进行测试。
1.2 光伏器件的制备与表征本实验采用氧化铟锡(ITO)/聚3, 4-乙烯二氧噻吩:聚苯乙烯磺酸盐(PEDOT:PSS)/活性层(聚合物:PC61BM)/PFN/Al的器件结构。由于所用ITO玻璃表面的清洁透光度和平整度均影响器件性能,因此使用前需将ITO玻璃置于清洗架上,先用清洗剂超声清洗10 min,然后用去离子水超声清洗10 min、丙酮超声清洗20 min,再次用去离子水超声清洗10 min,最后用异丙醇超声清洗20 min。接下来需用氮气吹干ITO玻璃,并用臭氧等离子体将其处理6 min。处理完成后,在ITO面旋涂约5 nm厚的PEDOT:PSS,160 ℃退火20 min后将其移至干燥且充满N2的手套箱里,使用旋涂仪以一定转速旋涂制备活性层,活性层为聚合物和PC61BM(聚合物和PC61BM质量比为1:1、1:1.5和1:2)的氯苯溶液,聚合物PTTBDT-BTA和PTTBDT-FBTA的氯苯溶液质量浓度分别为10 mg/mL和8 mg/mL。紧接着在优于3×10-4 Pa的真空蒸镀箱中蒸镀Al电极约100 nm,所制备的聚合物太阳能电池的有效面积为0.1 cm2。使用日本San-Ei的AAA模拟太阳光源(AM 1.5下的太阳光谱,其光强为100 mW/cm2)测试器件的PCE、JSC、UOC。材料的薄膜厚度用美国Bruker detakxt台阶仪测试。光伏器件的电流密度-电压特性曲线(J-U曲线)由模拟太阳光源和Keithley2400数字源表测试所得,使用北京赛凡光电XES-70S1仪器测得外量子效率(EQE)。
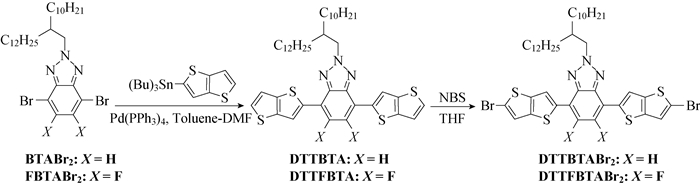
1.3 单体的合成 1.3.1 4, 7-双[噻并[3, 2-b]噻吩-2-基]-2-(2-癸基十四烷基)苯并[d][1, 2, 3]三氮唑(DTTBTA)的合成称取BTABr2 (1.0 g, 1.63 mmol)、TTSnBu3 (2.45 g, 5.70 mmol)、催化剂Pd(PPh3)4 (94 mg, 0.081 5 mmol)加入到100 mL三口瓶中,将体系抽真空并用氩气置换3次,加入30 mL甲苯和5 mL干N, N-二甲基甲酰胺(DMF),加热至115 ℃回流。薄层色谱(TLC)检测反应终点,停止反应。用二氯甲烷(DCM)分别萃取、水洗3次,收集有机相并用无水Na2SO4干燥。减压蒸除溶剂后过硅胶层析柱(48~75 μm),用石油醚(PE)和DCM(体积比为5:1)的混合溶剂作洗脱剂,得到0.7 g的深黄色固体DTTBTA, 产率为55.56%,熔点为101~103 ℃,其合成路线如图 1所示。
|
图 1 DTTBTABr2与DTTFBTABr2的合成路线 Fig. 1 Synthetic routes of DTTBTABr2 and DTTFBTABr2 |
1H-NMR (600 MHz, CDCl3,δ): 8.41 (s, 2H), 7.62 (s, 2H), 7.41 (d, J=5.2 Hz, 2H), 7.28 (d, J=5.2 Hz, 2H), 4.77 (d, J=6.7 Hz, 2H), 2.35 (m, 1H), 1.43~1.22 (m, 40H), 0.87 (m, 6H)。
1.3.2 4, 7-双[5-溴噻并[3, 2-b]噻吩-2-基]-2-(2-癸基十四烷基)苯并[d][1, 2, 3]三氮唑(DTTBTABr2)的合成称取DTTBTA (0.5 g, 0.68 mmol)至单口瓶中,加入35 mL无水THF将其完全溶解,避光下加入N-溴代丁二酰亚胺(NBS, 0.27 g, 1.5 mmol),常温搅拌过夜。TLC检测反应终点,用硫代硫酸钠水溶液淬灭反应。用DCM分别萃取、水洗3次,收集有机相,再用无水Na2SO4干燥。减压蒸除DCM后,用PE-DCM(体积比为1:1)混合溶剂作洗脱剂,柱层析纯化,再经正己烷重结晶得到0.57 g的橙黄色固体DTTBTABr2,产率为94%,熔点为138~141 ℃,其合成路线如图 1所示。
1H-NMR (600 MHz, CDCl3, δ): 8.29 (s, 2H), 7.58 (s, 2H), 7.28 (s, 2H), 4.76 (d, J=6.7 Hz, 2H), 2.35 (m, 1H), 1.44~1.21(m, 40H), 0.87 (m, 6H)。
13C-NMR (126 MHz, CDCl3, δ): 141.702, 141.126, 140.552, 137.603, 123.853, 122.355, 122.278, 119.326, 114.040, 60.098, 39.179, 39.164, 31.939, 31.926, 31.888, 31.835, 31.466, 29.951, 29.703 (m), 29.673 (m), 29.620, 29.589, 29.376, 29.340, 26.261, 26.200, 22.707, 22.672, 22.655, 14.140, 14.110, 14.089。
HRMS (m/z, FAB+, C42H55Br2N3S4), 理论值: 889.162 0;实验值: 889.161 5。
1.3.3 4, 7-双[噻并[3, 2-b]噻吩-2-基]-2-(2-癸基十四烷基)-5, 6-二氟苯并[d][1, 2, 3]三氮唑(DTTFBTA)的合成称取FBTABr2(1.0 g, 1.54 mmol)、TTSnBu3 (2.31 g, 5.40 mmol)、催化剂Pd(PPh3)4(88.9 mg, 0.077 mmol)加入到100 mL三口瓶中,将体系抽真空并用氩气置换3次,加入30 mL甲苯和5 mL DMF,加热至115 ℃回流。TLC检测反应终点,停止反应。用DCM分别萃取、水洗3次,收集有机相,无水Na2SO4干燥。减压蒸除DCM过硅胶层析柱,用PE-DCM(体积比为5:1)混合溶剂作洗脱剂,得到0.69 g的黄色固体DTTFBTA,产率为58%,熔点为99~101 ℃,其合成路线如图 1所示。
1H-NMR (600 MHz, CDCl3, δ):8.57 (s, 2H), 7.47 (d, J=5.2 Hz, 2H), 7.32 (d, J=5.2 Hz, 2H), 4.75 (d, J=6.6 Hz, 2H), 2.30 (m, 1H), 1.45~1.18 (m, 40H), 0.87 (m, 6H)。
1.3.4 4, 7-双[5-溴噻并[3, 2-b]噻吩-2-基]-2-(2-癸基十四烷基)-5, 6-二氟苯并[d][1, 2, 3]三氮唑(DTTFBTABr2)的合成称取DTTFBTA(0.5 g,0.65 mmol)于单口瓶中,加入30 mL无水THF将其完全溶解,避光下缓慢加入NBS (0.26 g,1.4 mmol),常温搅拌,反应过夜。TLC检测反应终点,用硫代硫酸钠水溶液淬灭反应。用DCM分别萃取、水洗3次,用无水Na2SO4干燥。减压蒸除DCM后经硅胶层析柱纯化,用PE-DCM(体积比为1:2)混合溶剂作洗脱剂,经正己烷重结晶得到0.58 g橙黄色固体DTTFBTABr2,产率为96%,熔点为142~145 ℃, 其合成路线如图 1所示。
1H-NMR (600 MHz, CDCl3, δ):8.44 (s, 2H), 7.31 (s, 2H), 4.75 (d, J=6.6 Hz, 2H), 2.30 (m, 1H), 1.45~1.18 (m, 40H), 0.87 (m, 6H)。
13C-NMR (126 MHz, CDCl3, δ): 148.015 (dd), 140.328 (m), 139.784, 137.284, 133.536, 122.120, 121.706, 115.335, 110.248 (m), 60.144, 39.160, 31.935, 31.928, 31.494, 29.956(m), 29.946, 29.715 (m), 29.673 (m), 29.375, 26.294, 22.703, 14.135。
HRMS (m/z, FAB+, C42H53Br2F2N3S4), 理论值: 925.143 1;实验值: 925.142 0。
1.3.5 单体2, 6-双(三甲基锡基)-4, 8-双[5-(2-丁基辛基)噻并[3, 2-b]噻吩-2-基]苯并[1, 2-b:4, 5-b′]二噻吩(TTBDTSn)的合成按照文献[29]合成,熔点为168~170 ℃。
1H-NMR (400 MHz, CDCl3, δ): 7.73 (t, J=10 Hz, 2H), 7.58 (s, 2H), 7.03 (s, 2H), 2.89 (d, J=6 Hz, 4H), 1.74 (s, 2H), 1.40~1.30 (m, 32H), 0.90 (t, J=8 Hz, 12H), 0.39 (t, J=19.6 Hz, 18H)。
13C-NMR (126 MHz, CDCl3, δ): 147.410, 143.729, 143.004, 140.156, 139.300, 137.564, 137.557, 131.003, 122.563, 120.229, 117.408, 40.018, 35.640, 33.198, 32.934, 31.941, 29.673, 28.910, 26.626, 23.08, 22.70, 14.21, 14.15。
HRMS (m/z, FAB+, C52H73S6Sn2), 理论值: 1 128.214 7;实验值: 1 128.216 2。
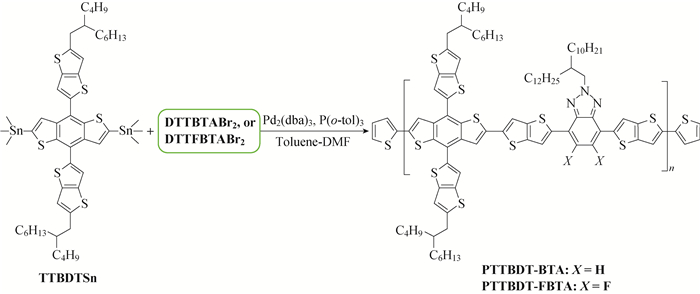
1.4 聚合物的合成 1.4.1 聚[4, 8-双[5-(2-丁基辛基)噻并[3, 2-b]噻吩-2-基]苯并[1, 2-b:4, 5-b′]二噻吩-2, 6-二基-alt-4, 7-双[噻并[3, 2-b]噻吩-2-基]-2-(2-癸基十四烷基)苯并[d][1, 2, 3]三氮唑-5, 5′-二基] (PTTBDT-BTA)的合成称取双锡TTBDTSn (169.3 mg,0.15 mmoL)和二溴物DTTBTABr2 (133.8 mg,0.15 mmoL)加入到25 mL的两口烧瓶中,密封装置,加入脱气甲苯(6 mL)和DMF (0.7 mL),搅拌,氩气鼓泡30 min后加入催化剂Pd2(dba)3 (1.5 mg)、P(o-tol)3 (2.5 mg),在氩气气氛下加热到105 ℃反应48 h。聚合反应完成后向反应体系中加入10 mg的2-三(正丁基锡基)噻吩和3 mg Pd(PPh3)4,在105 ℃下反应8 h来消除溴端基,接着加入2-溴噻吩(0.3 mL)和3 mg Pd(PPh3)4,继续在105 ℃下反应8 h以消除锡端基。将反应液滴至200 mL的甲醇中,抽滤收集固体,用约35 mL甲苯将其搅拌溶解。以甲苯为洗脱剂,过250 μm层析硅胶柱对其提纯,减压浓缩至约6 mL时再将其倾入250 mL甲醇中,抽滤收集固体,真空干燥24 h,得到166.0 mg的黑色固体状PTTBDT-BTA,产率为72.2%,其合成路线如图 2所示。Mn=18.0×103, Mw=37.8×103, PDI=2.10。
|
图 2 PTTBDT-BTA与PTTBDT-FBTA的合成路线 Fig. 2 Synthetic routes of PTTBDT-BTA and PTTBDT-FBTA |
1H-NMR (500 MHz, CDCl3, δ): 7.47~7.44 (br, ArH), 7.35~7.28 (m, ArH), 7.24~7.23 (m, ArH), 7.05 (br, ArH), 4.71 (br, NCH2), 2.88 (br, CH), 1.74~1.50 (m, CH, CH2), 1.39~1.25 (m, CH2), 1.10~0.78 (m, CH3)。
C88H111N3S10的元素分析理论值: wC=69.01%, wH=7.31%; wN=2.74%;实验值: wC=68.81%; wH=7.24%; wN=2.89%。
1.4.2 聚[4, 8-双[5-(2-丁基辛基)噻并[3, 2-b]噻吩-2-基]苯并[1, 2-b:4, 5-b′]二噻吩-2, 6-二基-alt-4, 7-双[噻并[3, 2-b]噻吩-2-基]-2-(2-癸基十四烷基)-5, 6-二氟苯并[d][1, 2, 3]三氮唑-5, 5′-二基] (PTTBDT-FBTA)的合成与聚合物PTTBDT-BTA的合成方法相同,分别称取双锡TTBDTSn (169.3 mg,0.15 mmoL)和二溴物DTFBTABr2 (138.5 mg,0.15 mmol)替代对应的用量, 得到172.0 mg的黑色固体状PTTBDT-FBTA,产率为73.1%,其合成路线如图 2所示。Mn=16.0×103, Mw=30.4×103, PDI=1.90。
1H-NMR (500 MHz, CDCl3, δ): 7.77~7.44 (m, ArH), 7.35~7.28 (m, ArH), 7.24~7.01 (m, ArH), 4.73 (br, NCH2), 2.89 (br, CH), 1.74~1.51 (m, CH, CH2), 1.37~0.96 (m, CH2), 0.94~0.80 (m, CH3)。
C88H109F2N3S10的元素分析理论值: wC=67.43%; wH=7.01%,wN=2.68%;实验值:wC=67.21%,wH=6.89%,wN=2.85%。
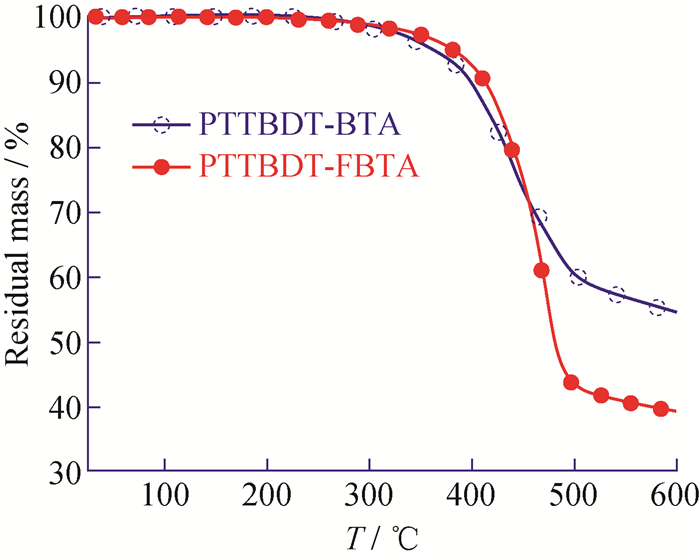
2 结果与讨论 2.1 聚合物的热性能在N2保护下,聚合物PTTBDT-BTA和PTTBDT-FBTA的热重曲线如图 3所示。由图 3可知,PTTBDT-BTA和PTTBDT-FBTA在失重5%时的温度(Td)分别为363 ℃和383 ℃,两者均具有良好的热稳定性,可以用作聚合物太阳能电池器件的活性层。氟原子引入后,材料的热稳定性提高了20 ℃,可能是因材料的F…H和F…S等非共价键作用力改善了材料的共面性所致[28]。
|
图 3 PTTBDT-BTA和PTTBDT-FBTA的热重分析曲线 Fig. 3 TG curves of PTTBDT-BTA and PTTBDT-FBTA |
2.2 聚合物的光学性能
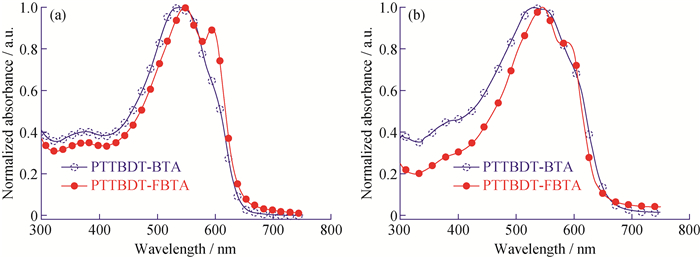
PTTBDT-BTA和PTTBDT-FBTA的甲苯稀溶液和固体薄膜的UV-Vis吸收光谱如图 4所示。在甲苯溶液状态下,聚合物PTTBDT-BAT在538 nm处出现一强而宽吸收峰、在373 nm处出现一强度较弱吸收峰、在598 nm处出现一强度很弱的肩峰,与文献所报道的以噻吩为π桥的BTA基共聚物PBnDT-HTAZ和PBDT-HBTA吸收峰形相似[20, 34]。在BTA上引入氟取代基后,最大吸收峰稍微红移且594 nm处出现了更为明显的肩峰,暗示PTTBDT-FBTA即使在稀溶液中亦存在较强的聚合物链间聚集。表 1是PTTBDT-BTA和PTTBDT-FBTA的光学和电化学的具体计算数据,由表 1可以看出,相比于甲苯溶液状态,固态薄膜PTTBDT-BTA的吸收光谱变宽且吸收带边(λonset)从641 nm红移到660 nm,而氟代的PTTBDT-FBTA的λonset则从636 nm红移到640 nm,较小的红移源于氟的引入大大改善了材料平面性。此外,根据Egopt=1 240/λonset可计算出PTTBDT-BTA和PTTBDT-FBTA固体薄膜的光学带隙(Egopt)分别为1.88、1.94 eV。强电负性的氟引入聚合物骨架中,使材料的光学带隙增大,与文献观察到的现象一致[20, 34]。
|
图 4 PTTBDT-BTA和PTTBDT-FBTA的甲苯溶液(a)及固态薄膜(b)的紫外-可见吸收光谱 Fig. 4 UV-Vis spectra of PTTBDT-BTA and PTTBDT-FBTA in toluene solution (a) and solid film state (b) |
|
|
表 1 聚合物PTTBDT-BTA和PTTBDT-FBTA的光学和电化学数据 Table 1 Optical and electrochemical data of PTTBDT-BTA and PTTBDT-FBTA |
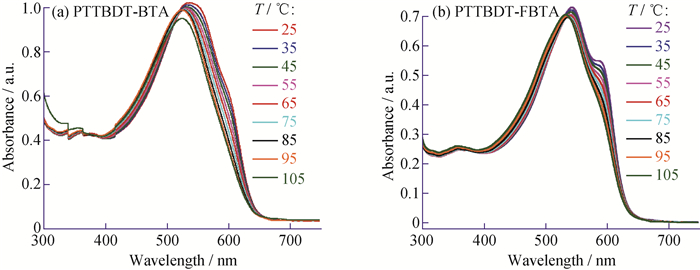
为了考察氟取代对聚合物溶液状态链间聚集效应的影响,在25~105 ℃以10 ℃为升温间隔测试了聚合物在氯苯稀溶液(10-5 mol/L)下的变温吸收(TD-Abs)光谱,如图 5所示。当温度从25 ℃升高到105 ℃时,PTTBDT-BTA的最大吸收峰从538 nm蓝移至525 nm,蓝移了13 nm,吸收强度降至初始的93%,当温度升高至75 ℃左右时,PTTBDT-BTA在598 nm左右处的弱肩峰完全消失,意味着聚合物弱的链间聚集效应已被完全破坏;对于氟代的PTTBDT-FBTA而言,即使温度升高到105 ℃,因氟原子引入而引起的与链间聚集紧密相关、位于594 nm左右处的肩峰逐渐减弱但并未消失,同时也观察到最大吸收峰从544 nm蓝移到534 nm,蓝移了10 nm,吸收强度变为初始的96%。随着溶液温度升高,聚合物骨架和侧链的运动能力增强,聚合物链内相邻单元的扭转角增大,聚合物骨架的共面性减弱,同时有效共轭长度降低,从而使吸收光谱发生蓝移。基于这些实验结果,本文推断氟取代的PTTBDT-FBTA在氯苯溶液状态具有比PTTBDT-BTA更强的链间聚集能力[4, 37]。
|
图 5 PTTBDT-BTA(a)和PTTBDT-FBTA(b)在氯苯溶液中的变温紫外-可见吸收光谱 Fig. 5 Temperature-dependent absorption spectra of PTTBDT-BTA(a) and PTTBDT-FBTA(b) in chlorobenzene |
2.3 电化学性能
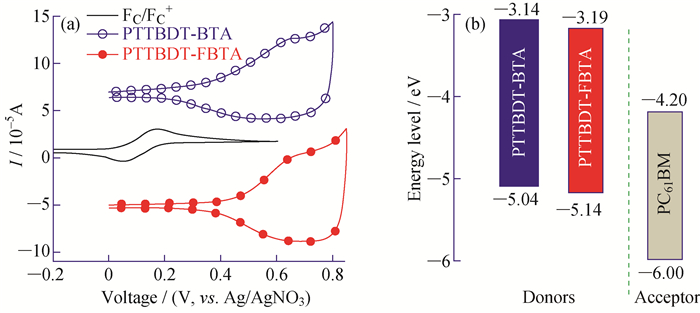
图 6是聚合物PTTBDT-BTA和PTTBDT-FBTA的CV曲线(图 6(a))和相应的能级结构示意图(图 6(b)),其氧化电位(φoxonset)分别为0.35 V和0.45 V,因此可根据公式EHOMO=-e(
|
图 6 PTTBDT-BTA和PTTBDT-FBTA的循环伏安曲线(a)和能级结构示意图(b) Fig. 6 CV curves (a) and energy level schematic diagram (b) of PTTBDT-BTA and PTTBDT-FBTA |
2.4 聚合物光伏性能研究
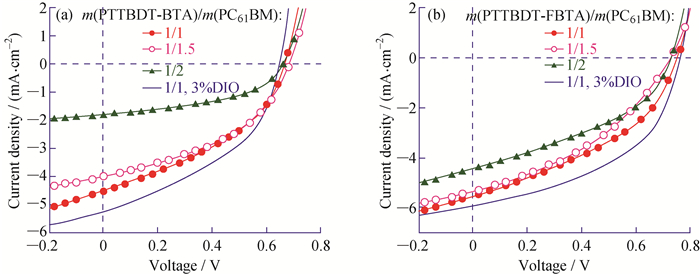
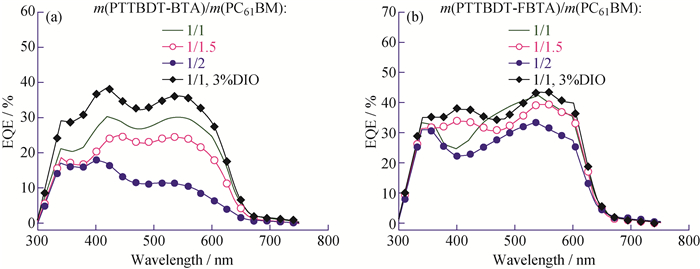
为了考察氟原子对含噻并[3, 2-b]噻吩π桥宽带隙共聚物的光伏性能的影响,制备了结构为ITO/PEDOT:PSS/PTTBDT-BTA或PTTBDT-FBTA:PC61BM/PFN/Al的太阳能电池器件。聚合物PTTBDT-BTA在氯苯中的质量浓度为10 mg/mL,控制旋涂仪的转速约为1 000 r/min于室温下制备光敏活性层薄膜,而氟代PTTBDT-FBTA的质量浓度为8 mg/mL并于80 ℃旋涂制膜。图 7为基于材料PTTBDT-BTA和PTTBDT-FBTA在模拟太阳光照射下的光伏器件的电流密度-电压(J-U)曲线,相应的器件数据见表 2。可以看出,无论PTTBDT-BTA:PC61BM还是PTTBDT-FBTA:PC61BM体系,最佳的给受体质量比均为1:1。由表 2可知,氟代材料对应器件的UOC和JSC明显增大,即使FF有所下降但PCE仍然提高。为了验证J-U测试的准确性,本文同时对相应器件的外量子效率(EQE)进行了测试,如图 8所示。2个含TT共轭π桥的聚合物在300~650 nm均有光电流产生。对于PTTBDT-BTA: PC61BM体系,随着PC61BM含量的增加,440~600 nm的EQE值出现明显下降;而PTTBDT-FBTA:PC61BM体系的EQE值随PC61BM含量增加变化较小。需指出的是,根据EQE曲线求得的积分电流数值与J-U测试结果基本吻合。
|
图 7 基于共混物PTTBDT-BTA:PC61BM (a)和PTTBDT-FBTA:PC61BM (b)的太阳能电池器件的J-U曲线 Fig. 7 J-U curves of the PSCs based on PTTBDT-BTA:PC61BM (a) and PTTBDT-FBTA:PC61BM (b) |
|
|
表 2 聚合物PTTBDT-BTA和PTTBDT-FBTA的光伏数据 Table 2 Photovoltaic parameters of copolymers PTTBDT-BTA and PTTBDT-FBTA |
|
图 8 基于共混物PTTBDT-BTA: PC61BM (a)和PTTBDT-FBTA: PC61BM (b)的光伏电池EQE曲线 Fig. 8 EQE curves of the PSCs based on PTTBDT-BTA: PC61BM (a) and PTTBDT-FBTA: PC61BM (b) |
相关研究表明溶剂添加剂1, 8-二碘辛烷(DIO)是一种改善光敏共混活性层微观形貌、提高电池性能的有效且易于操作的优化手段[4, 38]。因此,在光敏活性层溶液中添加DIO(DIO与光敏活性层溶液的体积比为3%,后文记为3%DIO)对其活性层形貌进行优化,相应的J-U图和EQE曲线见图 7和图 8所示。对PTTBDT-BTA:PC61BM体系,DIO使器件的UOC略有下降、JSC从4.53 mA/cm2提高到5.24 mA/cm2 (提高了15.7%)、FF从39.85%提高到42.49% (提高了6.62%)、PCE从1.20%提高到1.44%(提高了2.0%);而对PTTBDT-FBTA:PC61BM体系,使用DIO使器件的UOC基本恒定、JSC从5.56 mA/cm2提高到5.93 mA/cm2 (提高了6.65%)、FF从40.39%提高到47.51%(提高了17.6%)、PCE从1.68%提高到2.15%(提高了28.0%)。电池器件EQE的测试进一步印证了DIO的添加可以改善聚合物太阳能电池的性能。
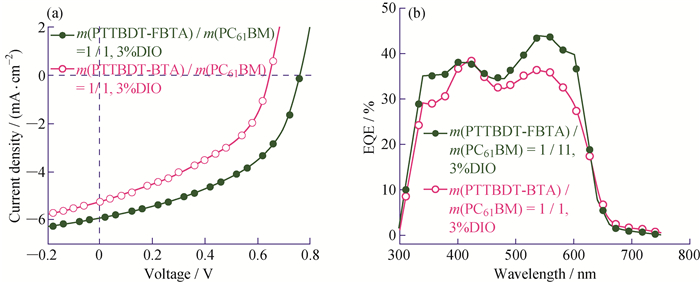
基于光敏活性层为PTTBDT-BTA:PC61BM和PTTBDT-FBTA:PC61BM最优电池的J-U曲线和EQE曲线如图 9所示。由图 9可知,氟取代使相应电池的UOC从0.65 V提高到0.76 V(提高了16.9%)、JSC从5.24 mA/cm2提高到5.93 mA/cm2(提高了13.2%)、FF从42.49%提高到47.51%(提高了11.8%)、PCE从1.44%提高到2.15%(提高了49.3%)。根据EQE曲线求得的积分电流密度分别为5.12 mA/cm2和5.81 mA/cm2,与J-U测试的变化趋势相符。可见氟取代是一种调节材料结构和改善光伏器件性能的有效手段。
|
图 9 基于PTTBDT-BTA和PTTBDT-FBTA的最佳J-U曲线(a)和相应电池的EQE曲线(b) Fig. 9 J-U curves (a) and EQE curves (b) of the PSCs based on PTTBDT-BTA and PTTBDT-FBTA under the optimal conditions |
2.5 聚合物光稳定性研究
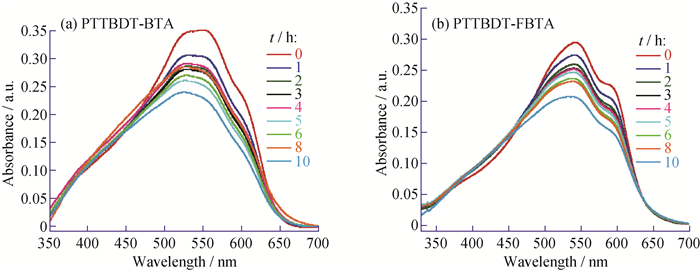
本体异质结型电池光敏层的电子给体材料的光稳定性是影响太阳能电池稳定性的一个重要因素[39-40]。为了研究材料的光稳定性,将聚合物PTTBDT-BTA和PTTBDT-FBTA的氯苯溶液旋涂制备厚度为30~50 nm的薄膜,然后在室温、空气中使用AM1.5模拟太阳光对薄膜照射,测得紫外-可见吸收光谱随光照时间的变化图,如图 10所示。研究表明,所研究的这2个聚合物的最大吸收峰(PTTBDT-BTA,536 nm;PTTBDT-FBTA,546 nm)随光照时间的增长,吸光强度逐渐降低。经10 h光照后,PTTBDT-BTA的最大吸收峰保持其初始值的68.08%,而PTTBDT-FBTA则保持了70.05%。可见,氟原子的引入有利于提高材料的光稳定性[41]。
|
图 10 PTTBDT-BTA (a)和PTTBDT-FBTA (b)薄膜在AM1.5模拟太阳光照射下空气中测定的UV-Vis谱图 Fig. 10 UV-Vis spectra of PTTBDT-BTA (a) and PTTBDT-FBTA (b) in film under AM1.5 sunlight illumination in air |
3 结论
(1) 成功合成了含噻并[3, 2-b]噻吩共轭π桥的BTA基D-π-A型宽带隙共聚物PTTBDT-BTA和PTTBDT-FBTA。
(2) 氟取代使聚合物的热稳定提高、溶解性稍微下降、薄膜态吸光范围稍微变窄、溶液状态聚合物链间聚集作用增强、固态薄膜的光稳定性提升和EHOMO下降。
(3) 氟取代使PTTBDT-FBTA基器件的PCE提高了49.3%,这获益于UOC提高了16.9%、JSC提高了13.2%和FF提高了11.8%。
| [1] | LI Gang, ZHU Rui, YANG Yang. Polymer solar cells[J]. Nat Photonics, 2012, 6(3): 153–161. DOI:10.1038/nphoton.2012.11 |
| [2] | 李永舫. 聚合物太阳能电池高效共轭聚合物给体和富勒烯受体光伏材料[J]. 高分子通报, 2011(10): 33–49. |
| [3] | ZHAO Wenchao, LI Sunsun, YAO Huifeng, et al. Molecular optimization enables over 13% efficiency in organic solar cells[J]. J Am Chem Soc, 2017, 139(21): 7148–7151. DOI:10.1021/jacs.7b02677 |
| [4] | TONG Junfeng, LI Jianfeng, ZHANG Peng, et al. Naphtho[1, 2-c:5, 6-c']bis[1, 2, 5] thiadiazole-based conjugated polymers consisting of oligothiophenes for efficient polymer solar cells[J]. Polymer, 2017, 121(14): 183–195. |
| [5] | GUO Pengzhi, LUO Guoping, SU Qiang, et al. Boosting up performance of inverted photovoltaic cells from bis(alkylthien-2-yl)dithieno[2, 3-d:2', 3'-d']benzo[1, 2-b:4', 5'-b']dithiophene-based copolymers by advantageous vertical phase separation[J]. ACS Appl Mater Interfaces, 2017, 9(12): 10937–10945. DOI:10.1021/acsami.6b15436 |
| [6] | HE Zhicai, ZHONG Chengmei, SU Shijian, et al. Enhanced power-conversion efficiency in polymer solar cells using an inverted device structure[J]. Nat Photonics, 2012, 6(9): 591–595. DOI:10.1038/nphoton.2012.190 |
| [7] | ZHANG Zhiguo, WANG Jizheng. Structures and properties of conjugated donor-acceptor copolymers for solar cell applications[J]. J Mater Chem, 2012, 22(10): 4178–4187. DOI:10.1039/c2jm14951f |
| [8] | CAI Ping, CHEN Zhenhui, ZHANG Lianjie, et al. An extended π-conjugated area of electron donating units in D-A structured polymers towards high-mobility field-effect transistors and highly efficient polymer solar cells[J]. J Mater Chem C, 2017, 5(11): 2786–2793. DOI:10.1039/C7TC00428A |
| [9] | WANG Xiao, SUN Yeping, CHEN Song, et al. Effects of π-conjugated bridges on photovoltaic properties of donor-π-acceptor conjugated copolymers[J]. Macromolecules, 2012, 45(6): 1208–1216. |
| [10] | KIM J H, PARK J B, XU Fei, et al. Effect of π-conjugated bridges of TPD-based medium bandgap conjugated copolymers for efficient tandem organic photovoltaic cells[J]. Energy Environ Sci, 2014, 7(12): 4118–4131. DOI:10.1039/C4EE02318H |
| [11] | INTEMANN J J, YAO Kai, LI Yongxi, et al. Highly efficient inverted organic solar cells through material and interfacial engineering of indacenodithieno[3, 2-b]thiophene-based polymers and devices[J]. Adv Funct Mater, 2014, 24(10): 1465–1473. DOI:10.1002/adfm.v24.10 |
| [12] | PAN Xuexue, XIONG Wentao, LIU Tao, et al. Influence of 2, 2-bithiophene and thieno[3, 2-b]thiophene units on the photovoltaic performance of benzodithiophene-based wide-bandgap polymers[J]. J Mater Chem C, 2017, 5(18): 4471–4479. DOI:10.1039/C7TC00720E |
| [13] | UNAY H, dos REIS BENATTO G A, BELIATIS M J, et al. High stability of benzotriazole and benzodithiophene containing medium band-gap polymer solar cell[J]. Sol Energy Mater Sol Cells, 2018, 174: 433–444. DOI:10.1016/j.solmat.2017.09.024 |
| [14] | UY R L, YAN Liang, LI Wentao, et al. Tuning fluorinated benzotriazole polymers through alkylthio substitution and selenophene incorporation for bulk heterojunction solar cells[J]. Macromolecules, 2014, 47(7): 2289–2295. DOI:10.1021/ma5001095 |
| [15] | KIM B, YEOM H R, YUN M H, et al. A selenophene analogue of PCDTBT:Selective fine-tuning of LUMO to lower of the bandgap for efficient polymer solar cells[J]. Macromolecules, 2012, 45(21): 8658–8664. DOI:10.1021/ma302133h |
| [16] | ZHANG Qianqian, KELLY M A, BAUER N, et al. The curious case of fluorination of conjugated polymers for solar cells[J]. Acc Chem Res, 2017, 50(9): 2401–2409. DOI:10.1021/acs.accounts.7b00326 |
| [17] | LECLERC N, CHAVEZ P, IBRAIKULOV O A, et al. Impact of backbone fluorination on π-conjugated polymers in organic photovoltaic devices:A review[J]. Polymers, 2016, 8(1): 11. DOI:10.3390/polym8010011 |
| [18] | ZHOU Huaxing, YANG Liqiang, STUART A C, et al. Development of fluorinated benzothiadiazole as a structural unit for a polymer solar cell of 7% efficiency[J]. Angew Chem, 2011, 50(13): 3051–3054. |
| [19] | IYER A, BJORGAARD J, ANDERSON T, et al. Quinoxaline-based semiconducting polymers:Effect of fluorination on the photophysical, thermal, and charge transport properties[J]. Macromolecules, 2012, 45(16): 6380–6389. DOI:10.1021/ma3009788 |
| [20] | PRICE S C, STUART A C, YANG Liqiang, et al. Fluorine substituted conjugated polymer of medium band gap yields 7% efficiency in polymer-fullerene solar cells[J]. J Am Chem Soc, 2011, 133(12): 4625–4631. DOI:10.1021/ja1112595 |
| [21] | ZHAO Li, LU Jianping, TSE S C, et al. Synthesis and applications of difluorobenzothiadiazole based conjugated polymers for organic photovoltaics[J]. J Mater Chem, 2011, 21(9): 3226–3233. DOI:10.1039/c0jm04166a |
| [22] | ALBRECHT S, JANIETZ S, SCHINDLER W, et al. Fluorinated copolymer PCPDTBT with enhanced open-circuit voltage and reduced recombination for highly efficient polymer solar cells[J]. J Am Chem Soc, 2012, 134(36): 14932–14944. DOI:10.1021/ja305039j |
| [23] | ZHANG Yong, ZOU Jingyu, CHEUH C C, et al. Significant improved performance of photovoltaic cells made from a partially fluorinated cyclopentadithiophene/benzothiadiazole conjugated polymer[J]. Macromolecules, 2012, 45(13): 5427–5435. DOI:10.1021/ma3009178 |
| [24] | XIAO Zeyun, SUBBIAH J, SUN Kuan, et al. Synthesis and photovoltaic properties of thieno[3, 2-b]thiophenyl substituted benzo[1, 2-b:4, 5-b']dithiophene copolymers[J]. Polym Chem, 2014, 5(23): 6710–6717. DOI:10.1039/C4PY00827H |
| [25] | LI Zhengke, LIN Haoran, JIANG Kui, et al. Dramatic performance enhancement for large bandgap thick-film polymer solar cells introduced by a difluorinated donor unit[J]. Nano Energy, 2015, 15: 607–615. DOI:10.1016/j.nanoen.2015.05.016 |
| [26] | KAWASHIMA K, FUKUHARA T, SUDA Y, et al. Implication of fluorine atom on electronic properties, ordering structures, and photovoltaic performance in naphthobisthiadiazole-based semiconducting polymers[J]. J Am Chem Soc., 2016, 138(32): 10265–10275. DOI:10.1021/jacs.6b05418 |
| [27] | KIM J, PARK J B, LEE W H, et al. High-performance fluorine-containing BDT-based copolymer for organic solar cells with a high open circuit voltage[J]. J Polym Sci:Part A. Polym Chem, 2017, 55(15): 2506–2512. DOI:10.1002/pola.v55.15 |
| [28] | ZHANG Qianqian, YAN Liang, JIAO Xuechen, et al. Fluorinated thiophene units improve photovoltaic device performance of donor-acceptor copolymers[J]. Chem Mater, 2017, 29(14): 5990–6002. DOI:10.1021/acs.chemmater.7b01683 |
| [29] | 孙景彪, 郭鹏智, 同军锋. 氟对噻并噻吩-苯并二噻吩基共聚物光伏性能的影响[J]. 广州化工, 2017, 45(6): 96–101. |
| [30] | HUO Zejuan, ZHANG Peng, LI Jianfeng, et al. Wide bandgap conjugated polymers based on bithiophene and benzotriazole for bulk heterojunction solar cells:Thiophene versus thieno[3, 2-b]thiophene as π-conjugated spacers[J]. J Macromol Sci A, 2017, 54(9): 565–574. DOI:10.1080/10601325.2017.1309250 |
| [31] | FULLER L S, IDDON B, SMITH K A. Thienothiophenes:Part 2. Synthesis, metallation and bromine→lithium exchange reactions of thieno[3, 2-b]thiophene and its polybromo derivatives[J]. J Chem Soc Perkin Trans 1, 1997, 29(13): 3465–3470. |
| [32] | HUANG Fei, WU Hongbin, WANG Deli, et al. Novel electroluminescent conjugated polyelectrolytes based on polyfluorene[J]. Chem Mater, 2004, 16(4): 708–716. DOI:10.1021/cm034650o |
| [33] | TONG Junfeng, AN Lili, LI Jianfeng, et al. Large branched alkylthienyl bridged naphtho[1, 2-c:5, 6-c']bis[1, 2, 5] -thiadiazole-containing low bandgap copolymers:Synthesis and photovoltaic application[J]. J Macromol Sci A, 2017, 54(3): 176–185. DOI:10.1080/10601325.2017.1265404 |
| [34] | MIN Jie, ZHANG Zhiguo, ZHAGN Siyuan, et al. Conjugated side-chain-isolated donor-acceptor copolymers based on benzo[1, 2-b:4, 5-b']dithiophene-alt-thipheneylbenzotriazole:Synthesis and photovoltaic properties[J]. Chem Mater, 2012, 24(16): 3247–3254. DOI:10.1021/cm3017006 |
| [35] | ZHU Dangqiang, BAO Xichang, ZHU Qianqian, et al. Thienothiophene-based copolymers for high-performance solar cells, employing different orientations of the thiazole group as a π bridge[J]. Energy Environ Sci, 2017, 10(2): 614–620. DOI:10.1039/C6EE03186B |
| [36] | POMMEREHNE J, VESTWEBER H, GUSS W, et al. Efficient two layer leds on a polymer blend basis[J]. Adv Mater, 1995, 7(6): 551–554. DOI:10.1002/adma.v7:6 |
| [37] | QI Boyuan, WANG Jizheng. Open-circuit voltage in organic solar cells[J]. J Mater Chem, 2012, 22(46): 24315–24325. DOI:10.1039/c2jm33719c |
| [38] | GUADAL N S, BERLINGHOF M, KASSAR T, et al. Controlling additive behavior to reveal an alternative morphology formation mechanism in polymer:Fullerene bulk-heterojunctions[J]. J Mater Chem A, 2016, 4(11): 16136–16147. |
| [39] | 李自东, 赵晓礼, 杨小牛. 聚合物太阳能电池器件热稳定性的研究进展[J]. 应用化学, 2016, 33(1): 1–17. DOI:10.11944/j.issn.1000-0518.2016.01.150399 |
| [40] | GAO Peili, TONG Junfeng, GUO Pengzhi, et al. Medium band gap conjugated polymers from thienoacene derivatives and pentacyclic aromatic lactam as promising alternatives of poly(3-hexylthiophene) in photovoltaic application[J]. J Polym Sci:Part A. Polym Chem, 2018, 56(1): 85–95. DOI:10.1002/pola.v56.1 |
| [41] | LEE H S, SONG H G, JUNG H, et al. Effects of backbone planarity and tightly packed alkyl chains in the donor-acceptor polymers for high photostability[J]. Macromolecules, 2016, 49(20): 7844–7856. DOI:10.1021/acs.macromol.6b01580 |
 2018, Vol. 31
2018, Vol. 31


