脂肪族聚酯具有优良的物理性能、生物相容性和生物可降解性等优点,在生物医用材料领域应用广泛[1-3]。然而,聚酯主链的疏水性以及缺少活性官能团的特性,限制了其更广泛的应用。功能化聚酯不仅克服了这些缺点,还赋予了其新的优良性能,因此聚酯的功能化是当今发展脂肪族聚酯的必然趋势。环内酯的开环聚合是实现脂肪族聚酯可控制备的主要手段之一,可以通过调整单体组成、端基种类、控制序列分布以及拓扑结构等方式来合成具有特殊性能的聚合物[4-5]。如黄晓宇等[6-7]首先合成一种侧链上带有端羟基的丙烯酸酯类大分子引发剂,然后引发己内酯(CL)或乳酸(LA)进行开环聚合并通过后修饰制备具有pH响应性的PAA-g-PCL胶束和两亲性梳型结构的PEG-b-(PAA-g-PLA)载药微球。目前,关于环内酯的开环聚合主要是以金属[8]、有机金属[9-11]以及有机化合物[12-14]作为催化剂实现的。然而,这些催化剂在催化內酯开环聚合的过程中常常伴随着副反应的发生。例如,Duchateau等[4]在100 ℃的高温下,采用含铝的有机金属催化剂通过开环聚合制备聚环丁烯对苯二甲酸乙二酯-b-聚己内酯嵌段共聚物,在后续投入CL时易发生酯交换副反应。此外,采用这类催化剂制备的聚酯,往往在聚合物中存在有机金属残留[15],极大地限制了其在生物医用材料领域的应用。
酶作为一种绿色、安全、高效且反应条件温和的生物催化剂,是解决这类问题的理想选择[16]。近年来,采用酶催化制备官能化聚酯类材料越来越受到关注。Li等[17]利用两末端都带有羟基的聚(3-甲基丙内酯)(PHB)作为大分子引发剂,通过酶催化三亚甲基碳酸酯(TMC)开环聚合,成功制备了PHB-b-PTMC两嵌段共聚物,这种聚合物表现出良好的热塑性弹性体性能。卓仁禧等[18]以固定化CALB酶(Novozym 435)为催化剂,分步引发含叔胺基团的大环碳酸酯(ADMC)和CL开环聚合,成功制备了PCL-b-PADMC-b-PCL三嵌段共聚物,该聚合物可自组装成具有pH响应性胶束,在药物缓释领域具有一定的应用前景。此外,Becker等[19]以功能性炔烃醇为引发剂,采用酶催化己内酯开环聚合,合成了含有炔烃官能团的聚己内酯,可通过点击化学对官能化聚酯进行后修饰来制备功能性生物材料。
本文以4-甲酸苄基哌啶内酯(NPIL)为原料,采用钯炭(Pd-C)加氢催化脱保护的方法制备了含仲胺的功能性哌啶内酯(PIL)单体,研究了PIL与CL分别在酶(Novozym 435)和有机金属催化剂异烯酸亚锡(Sn(Oct)2)的催化作用下进行开环聚合,制备阳离子P(PIL-co-CL)共聚物,并探索了在不同催化体系下聚合产物的结构组成、数均分子量及其分布和热学性能的差异。此外,共聚物主链上含有可反应的仲胺基团,为共聚物后续的功能化修饰打下了基础。
1 实验部分 1.1 原料和试剂CL、Sn(Oct)2:分析纯,Sigma Aldrich试剂公司;Novozym 435:优级纯,丹麦诺维信公司;Pd-C:w(Pd)=5%, 上海阿拉丁生化科技股份有限公司;氢溴酸、甲苯、苯甲醇、二氯甲烷、无水乙醚、重水、氘带氯仿:分析纯,上海泰坦科技股份有限公司;NPIL:自制。
1.2 原料和试剂的预处理CL的干燥:量取300 mL的CL加入到500 mL的单口烧瓶中,加入适量的的氢化钙进行干燥,充分搅拌24 h,然后在110 ℃油浴条件下进行减压蒸馏,即得到纯化后的干燥CL,然后在双排管上置换气体,最后用惰性气体进行保存,备用。
苯甲醇、二氯甲烷(CH2Cl2)的干燥:采用上述CL的干燥方法,使用CaH2干燥24 h,减压蒸馏并用惰性气体保存,备用。
Novozym 435的干燥:称取一定量的Novozym 435置于真空干燥箱上层中,在下层加入一定量的五氧化二磷(P2O5),升温至50 ℃干燥24 h,最后置于干燥器中保存,备用。
1.3 实验过程 1.3.1 PIL的制备称取3.2 g (27.8 mmol) NPIL溶于50 mL四氢呋喃-甲醇(体积比4:1)的混合溶液中,待其溶解完全后,加入0.64 g (单体质量的20%) Pd-C,抽真空排除里面的空气,然后将氢气持续通入反应球瓶中,在常温反应72 h,采用点板跟踪反应的进程,待反应结束后,用砂芯漏斗过滤掉Pd-C,滤液在45 ℃下进行旋转蒸发,浓缩得到粗产物,然后再采用甲醇-乙酸乙酯(体积比1:2)混合溶液重结晶得到PIL。
1.3.2 P(PIL-co-CL)的制备以Novozym 435为催化剂:在干燥的10 mL反应球瓶中加入0.5 g (4.4 mmol) PIL、1.5 g (13.2 mmol) CL和9.5 mg (0.088 mmol)苯甲醇后,进行气体置换3次,置于45 ℃的油浴中抽真空并持续搅拌3 h。然后将0.2 g (总单体质量的10%) Novozym 435加入反应球瓶中,进行气体置换3次,在惰性气体保护的氛围下进行封口,升温至60 ℃反应24 h。反应结束后,加入2 mL CH2Cl2溶解产物,然后采用砂芯漏斗过滤除去固体酶Novozym 435,滤液中加入0.1 mL HBr,搅拌5 min后,在无水乙醚中进行沉降、真空干燥得到产物。
以Sn(Oct)2为催化剂:在干燥的10 mL反应球瓶中加入0.5 g (4.4 mmol) PIL、1.5 g(13.2 mmol) CL和9.5 mg (0.088 mmol)苯甲醇后,进行气体置换3次,置于45 ℃的油浴中抽真空并持续搅拌3 h。然后通过微量注射器将50 μL的Sn(Oct)2 (10 mg, 总单体质量的0.5%)甲苯溶液加入反应球瓶中,继续搅拌10 min,以除去其中微量的甲苯。之后换气3次,在惰性气体保护的氛围下进行封口,升温至120 ℃反应24 h。反应结束后,加入2 mL的CH2Cl2溶解产物,溶解完全后再加入0.1 mL的HBr,搅拌5 min后,将其在无水乙醚中进行沉降、真空干燥得到产物。
1.4 测试与表征核磁共振氢谱(1H-NMR)、碳谱(13C-NMR)采用德国布鲁克公司Bruker 400 MHz和125 MHz核磁共振波谱仪测定,以重水、氘带氯仿为溶剂,四甲基硅烷(TMS)为内标;傅里叶红外变换光谱(FT-IR)采用美国尼高力仪器公司Nicolet 5700型傅里叶红外光谱仪测定,通过固体溴化钾(KBr)制样;凝胶渗透色谱(GPC)采用美国Waters公司的2414型仪器测定,采用N, N-二甲基甲酰胺(DMF)为流动相,以单分散性的聚甲基丙烯酸甲酯为基准;电子轰击质谱(EI-MS)采用英国卡拉托斯公司MS50型质谱仪,采取直接进样方式,扫描范围m/z: 35~250;美国DSC2910差示扫描量热仪(DSC),在氮气保护下,升温速率为10 ℃/min,温度范围为―100~100 ℃;热重分析(TG)为德国NETZSCH STA 449 F3型号,在氮气保护下,升温速率为10 ℃/min,温度范围为25~600 ℃。
2 结果与讨论 2.1 合成路线本文将含有仲胺基团的水溶性单体PIL引入到PCL中,制备了阳离子共聚物P(PIL-co-CL),具体的合成路线如图 1所示。
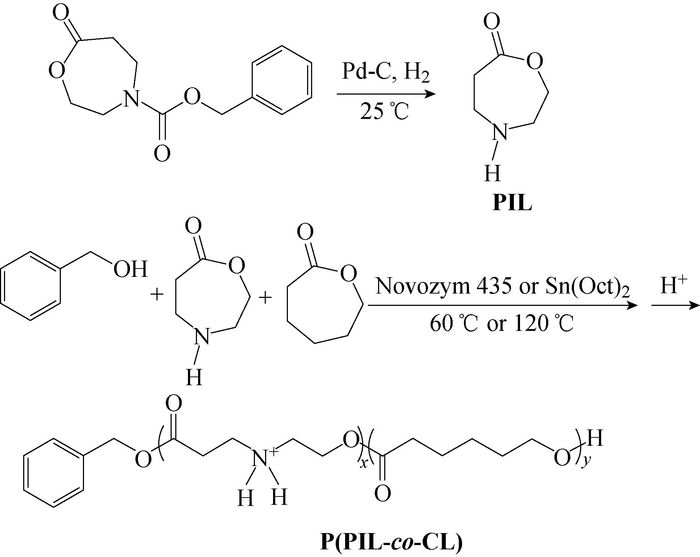
|
图 1 PIL和P(PIL-co-CL)的合成路线 Fig. 1 Synthetic routes of PIL and P(PIL-co-CL) |
2.2 PIL的结构表征
图 2(A)为PIL和NPIL单体的核磁共振氢谱。2个单体中的所有氢的特征峰都在谱图上标出。对比PIL和NPIL的核磁图,NPIL单体的f′峰(苯环,7.23)和e′峰(亚甲基,5.10) 2处峰在PIL图中均已消失,说明保护基团苄基已经成功脱除。其余的峰与NPIL上相应峰的化学位移相差较大,这是因为PIL上仲胺基团的出现导致了化学位移偏移。PIL在化学位移3.2处的单峰可能是PIL的活泼性氢e的归属峰。为了进一步确认保护基团的脱除,通过红外光谱进行表征。图 2(B)为PIL和NPIL单体的红外谱图。NPIL中1 735 cm-1和1 703 cm-1处分别为主链上和侧链上羰基的(—C=O)的伸缩振动吸收峰,1 471~1 500 cm-1处为苯环骨架的伸缩振动吸收峰,700~730 cm-1处为苯环上的—C—H面外弯曲振动吸收峰。而在PIL中,关于保护基团甲酸苄酯基的700~730,1 703,1 471~1 500 cm-1的红外吸收峰均已消失,这也表明了保护基团(甲酸苄酯基)的确已成功脱除。
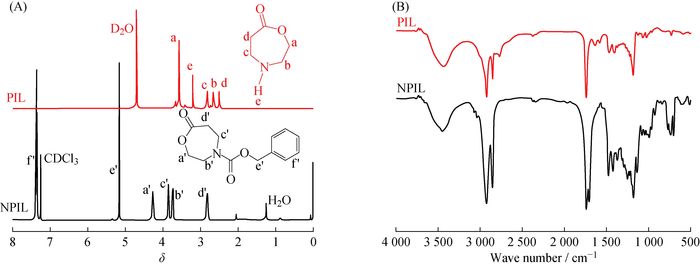
|
图 2 PIL和NPIL的核磁共振氢谱(A)和红外谱图(B) Fig. 2 1H-NMR (A) and FT-IR (B) spectra of PIL and NPIL |
为进一步验证脱保护产物PIL的结构,对其进行了电子轰击质谱(EI-MS)表征,结果如图 3所示。在丰度为100%时所对应的质荷比值(m/z)为116.1。通过分析分子离子峰[M]+1=116.1,得出相对分子质量为115.1,与PIL的理论相对分子质量相符,进一步验证了PIL单体的合成。综合核磁、红外和质谱结果可知,PIL单体被成功制备。
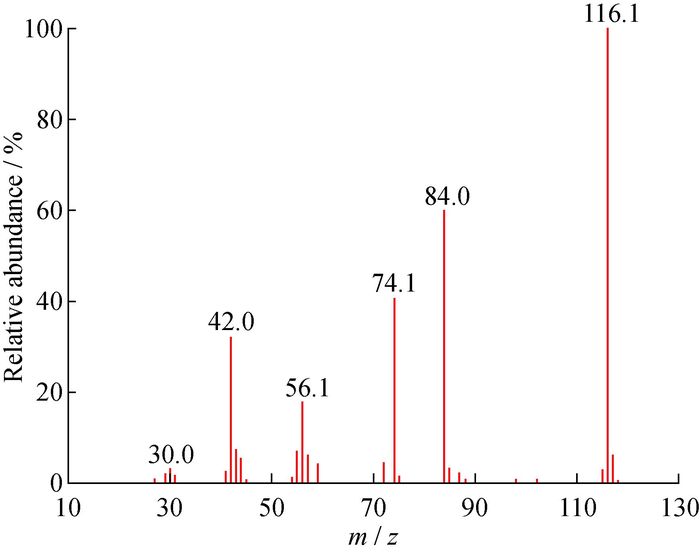
|
图 3 PIL的质谱图 Fig. 3 EI-MS spectrum of PIL |
2.3 P(PIL-co-CL)的结构表征
图 4为以Novozym 435或者Sn(Oct)2为催化剂分别进行开环聚合得到的聚合物的核磁共振氢谱图。从图中可以看出,这2种聚合物中的每个氢在谱图中均能找到相应的归属。其中在7.23和5.15处分别为引发剂苯甲醇上的苯环氢的质子峰(峰1)和亚甲基氢的质子峰(峰2) (因为设计的聚合度较大,峰2不明显)。3.60~3.80处为与N原子相连的2个亚甲基氢(峰4和峰5)的质子峰,并且较单体PIL的出峰位置有明显的偏移。可以得出,在Novozym 435或Sn(Oct)2催化剂作用下,均可成功制备阳离子聚合物P(PIL-co-CL)。通过峰2与峰3或者峰7的面积比可以计算出每个单元的聚合度。当单体投料比nPIL:nCL=50:150时,采用Novozym 435为催化剂时,共聚产物中nPIL:nCL=46:142;使用Sn(Oct)2为催化剂时,nPIL:nCL=36:135。可见,Novozym 435催化制备聚合物P(PIL-co-CL)的分子量的可控性更好。这可能是因为Sn(Oct)2催化聚合反应温度过高,反应后期易出现酯交换反应,同时活泼基团仲胺可能发生副反应,从而使最终共聚产物P(PIL-co-CL)分子量偏低。通过P(PIL-co-CL)红外谱图 4(B)进一步验证推测,以Novozym 435为催化剂的产物谱线中,3 415 cm-1和1 029~1 105 cm-1处分别为—N—H和—C—O—C—的伸缩振动吸收峰,明显比以Sn(Oct)2为催化剂的产物的峰型强,也可以佐证这种可能的原因。
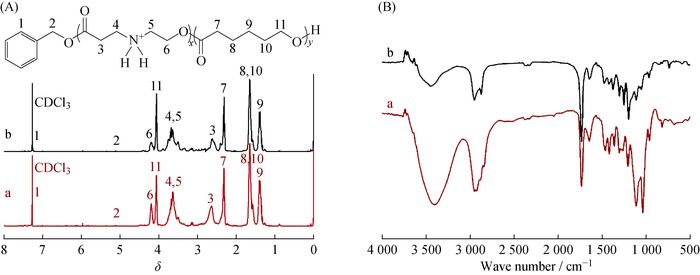
|
Catalyst: a—Novozym 435, b—Sn(Oct)2 图 4 P(PIL-co-CL)的核磁共振氢谱(A)和红外光谱(B) Fig. 4 1H-NMR (A) and FT-IR (B) spectra of P(PIL-co-CL) |
2.4 P(PIL-co-CL)的热性能表征
图 5(a)是聚合物P(PIL-co-CL)的DSC表征结果。对比共聚物P(PIL-co-CL)的DSC曲线可知,不同催化剂制备的聚合物的熔点(Tm)和玻璃化转变温度(Tg)均有差异。当以Novozym 435作为催化剂时,聚合物的Tm为52 ℃,Tg 为-50 ℃;而以Sn(Oct)2为催化剂时,聚合物的Tm为20 ℃,Tg为-54 ℃。说明内酯开环聚合的催化方式对聚合物的Tm和Tg影响较大。共聚物的热重(TG)分析如图 5(b)所示,2种聚合物的热分解曲线基本上一样,均在200 ℃左右开始分解,分解温度(Td)在300 ℃左右。这是因为2种聚合物的结构虽有些差异,但对聚合物的分解温度影响不大。综合DSC和TG结果可知,以不同催化剂制备的聚合物P(PIL-co-CL),其Tm和Tg有较大差异,但Td基本一样。
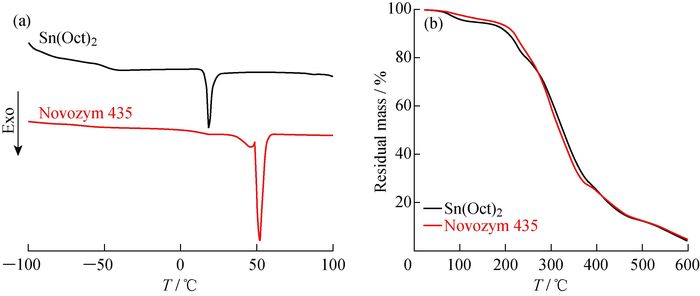
|
图 5 P(PIL-co-CL)的DSC曲线(a)和热重曲线(b) Fig. 5 DSC (a) and TG (b) curves of P(PIL-co-CL) |
2.5 P(PIL-co-CL)聚合物的性能差异分析
表 1为分别以Novozym 435和Sn(Oct)2为催化制得的聚合物P(PIL-co-CL)的数均分子量和热性能结果。当nPIL:nCL=1:1时,因为反应是本体聚合,CL含量较少不足以充当共溶剂使反应进行,故聚合无法进行。由表可知,以Novozym 435或Sn(Oct)2作为催化剂均能催化内酯开环聚合制备阳离子聚合物P(PIL-co-CL)。然而,对照GPC和1H-NMR计算的聚合物数均分子量,Novozym 435催化制备的P(PIL-co-CL)聚合物分子量更接近理论值。这是因为Sn(Oct)2作为催化剂时,反应在120 ℃的高温下进行,反应后期易出现酯交换,同时PIL环上的仲胺基团可能发生了副反应,导致聚合物分子量稍微降低。而Novozym 435作为催化剂时,反应条件温和,避免了副反应的发生,而且反应过程更可控,得到的聚合物的数均分子量更接近于理论值。其中,GPC测得数均分子量明显偏低,这是由阳离子型聚合物与标样PMMA在DMF中的流体力学体积差异引起的。除此之外,Novozym 435和Sn(Oct)2催化下分别得到的P(PIL-co-CL)聚合物在结构上存在差异,因而共聚物的Tm和Tg差异较大,但Td基本不变。
|
|
表 1 聚合物P(PIL-co-CL)的数均分子量和热性质 Table 1 Molecular weight and thermal properties of P(PIL-co-CL) |
3 结论
(1) 采用Pd-C催化加氢方法,通过对NPIL进行脱保护,成功制备了PIL。
(2) 以Novozym 435或者Sn(Oct)2为催化剂,以苯甲醇为引发剂,引发CL和PIL进行开环共聚、酸化,成功制备了阳离子聚合物P(PIL-co-CL)。
(3) 相较有机金属催化剂催化内酯开环聚合,固定化酶Novozym 435催化具有反应温和、绿色、高效且无副反应的优点。此外,不同催化剂制备的P(PIL-co-CL),其Tm和Tg有较大差异,但Td基本一致。
| [1] | BOUYAHYI M, PEPELS M P F, HEISE A, et al. ω-Pentandecalactone polymerization and ω-pentadecalactone/ε-caprolactone copolymerization reactions using organic catalysts[J]. Macromolecules, 2012, 45(8): 3356–3366. DOI:10.1021/ma3001675 |
| [2] | 阳范文, 聂凤明, 朱锐钿, 等. PDLLA-PCL共混材料的制备与性能[J]. 功能高分子学报, 2015, 28(2): 172–177. |
| [3] | TIAN Huayu, TANG Zhaohui, ZHUANG Xiuli, et al. Biodegradable synthetic polymers:Preparation, functionalization and biomedical application[J]. Progress in Polymer Science, 2012, 37(2): 237–280. DOI:10.1016/j.progpolymsci.2011.06.004 |
| [4] | PEPELS M P F, VAN DER SANDEN F, GUBBELS E, et al. Catalytic ring-opening (co)polymerization of semiaromatic and aliphatic (macro)lactones[J]. Macromolecules, 2016, 49(12): 4441–4451. DOI:10.1021/acs.macromol.6b00744 |
| [5] | 郎思睆, 肖艳, 李进杰, 等. 基于星型聚4-甲基-ε-己内酯的光交联网络合成与性能表征[J]. 功能高分子学报, 2016, 29(3): 267–273. |
| [6] | SONG Xuemei, YAO Wenqiang, LU Guolin, et al. tBHBMA:A novel trifunctional acrylic monomer for the convenient synthesis of PAA-g-PCL well-defined amphiphilic graft copolymer[J]. Polymer Chemistry, 2013, 4(9): 2864–2875. DOI:10.1039/c3py00046j |
| [7] | QIAN Wenhao, SONG Xuemei, FENG Chun, et al. Construction of PEG-based amphiphilic brush polymers bearing hydrophobic poly(lactic acid) side chains via successive RAFT polymerization and ROP[J]. Polymer Chemistry, 2016, 7(19): 3300–3310. DOI:10.1039/C6PY00189K |
| [8] | DOVE A P. Controlled ring-opening polymerization of cyclic esters:Polymer blocks in self-assembled nanostructures[J]. Chemical Communication, 2008, 48(48): 6446–6470. |
| [9] | MILIONE S, GRISI F, CENTORE R, et al. Neutral and cationic heteroscorpionate aluminum complexes:Synthesis, structure, and ring-opening polymerization of ε-caprolactone[J]. Organometallics, 2006, 25(1): 266–274. DOI:10.1021/om050902e |
| [10] | CHEN Leilei, DING Liqin, ZENG Chu, et al. Bulk solvent-free melt ring-opening polymerization of L-lactide catalyzed by Cu(Ⅱ) and Cu(Ⅱ)-Nd(Ⅲ) complexes of the Salen-type Schiff-base ligand[J]. Applied Organometallic Chemistry, 2011, 25(4): 310–316. DOI:10.1002/aoc.1760 |
| [11] | MEULEN I, GUBBELS E, HUIJSER S, et al. Catalytic ring-opening polymerization of renewable macrolactones to high molecular weight polyethylene-like polymers[J]. Macromolecules, 2011, 44(11): 4301–4305. DOI:10.1021/ma200685u |
| [12] | WILSON J A, HOPKINS S A, WRINGHT P M, et al. Dependence of copolymer sequencing based on lactone ring size and ε-substitution[J]. ACS Macro Letters, 2016, 5(3): 346–350. DOI:10.1021/acsmacrolett.5b00940 |
| [13] | NAUMANN S, SCHOLTEN P B V, WILSON J A, et al. Dual catalysis for selective ring-opening polymerization of actones:Evolution toward simplicity[J]. Journal of the American Chemical Society, 2015, 137(45): 14439–14445. DOI:10.1021/jacs.5b09502 |
| [14] | TODD R, TEMPELAAR S, GIADA L R, et al. Poly(ω-pentadecalactone)-b-poly(L-lactide) block copolymers via organic-catalyzed ring opening polymerization and potential applications[J]. ACS Macro Letters, 2015, 4(4): 408–411. DOI:10.1021/acsmacrolett.5b00021 |
| [15] | AJELLA N, CARPENTIER J F, GUILLAUME C, et al. Metal-catalyzed immortal ring-opening polymerization of lactones, lactides and cyclic carbonates[J]. Dalton Trans, 2010, 39(36): 8363–8376. DOI:10.1039/c001226b |
| [16] | SHODA S, UYAMA H, KADOAWA J, et al. Enzymes as green catalysts for precision macromolecular synthesis[J]. Chemical Reviews, 2016, 116(4): 2307–2413. DOI:10.1021/acs.chemrev.5b00472 |
| [17] | DAI Shiyao, XUE Liang, LI Zhi. Enzymatic ring-opening polymerization of trimethylene carbonate with macrodiol:Synthesis of block poly(ester-co-carbonate) for biomaterial preparation[J]. ACS Catalysis, 2011, 1(10): 1421–1429. DOI:10.1021/cs200407n |
| [18] | WANG Huafen, LUO Xiaohua, LIU Chenwei, et al. A smart micellar system with an amine-containing polycarbonate shell[J]. Acta Biomaterialia, 2012, 8(2): 589–598. DOI:10.1016/j.actbio.2011.08.030 |
| [19] | CASTANO M, ZHENG Jukuan, PUSKAS J E, et al. Enzyme-catalyzed ring-opening polymerization of ε-caprolactone using alkyne functionalized initiators[J]. Polymer Chemistry, 2014, 5(6): 1891–1896. DOI:10.1039/C3PY01536J |
 2017, Vol. 30
2017, Vol. 30


