由于Kim和Webster的开创性工作,超支化聚合物(HBP)引起了广泛的关注,并已被应用于催化、生物材料、微电子学和纳米药物等领域[1-5]。与线性聚合物相比,超支化聚合物具有更好的加工性、相容性和溶解性,这归因于其高度支化的三维结构、海绵状内部结构和大量的外围功能[6-9]。与树枝状聚合物不同,超支化聚合物更容易合成,通常只需一步反应和简单的沉淀纯化即可,节省了大量的制造时间和成本[10]。因此超支化聚合物更易于商用化。目前人们已经采用不同的合成策略来制备超支化聚合物[11]。一般情况下,都是通过ABn(n≥2)型单体的聚合[12-15]或通过A2和B3单体[16-18]或其他多官能单体的共聚[19]来制备超支化聚合物。其中,支化度(DB)是HBP表征的关键参数之一,对HBP的结构与性能影响很大[10, 20-21]。
自20世纪80年代发现含有(Z)-己-3-烯-1, 5-二炔片段的天然抗生素,烯二炔已越来越多地应用于有机合成和材料化学[22-23]。烯二炔可以通过Bergman环化反应产生的苯基双自由基中间体,这种自由基的活性很高,不仅可以在生理条件下引起DNA断裂,而且还可以作为聚合反应中的自由基引发剂[24]。
小分子烯二炔已被广泛应用于生物学、药物化学和材料科学等领域,关于小分子烯二炔的合成和反应的文献也已大量涌现。本课题组一直致力于小分子烯二炔的合成及应用的研究,但是有关于大分子烯二炔的制备和研究却很少。本文通过一锅法Sonogashira交叉偶联反应,由AB2型单体制备含有嵌入的烯二炔部分和外围有大量碘基团的HBPs,并且通过用苯基乙炔等其他炔源作为封端剂进行改性使HBPs官能化,以得到具有烯二炔重复单元的一系列HBPs。
1 实验部分 1.1 主要试剂 1.1.1 主要原料二氯马来酸酐(纯度99%)、苯乙炔、对甲基苯乙炔(纯度98%):上海达瑞精细化学品有限公司;炔丙胺:纯度97%,梯希爱(上海)化成工业发展有限公司;对氨基苯乙炔(纯度97.5%)、2-甲基-3-丁炔-2-胺(纯度95%):百灵威科技有限公司;碘化亚铜:纯度99%,国药集团化学试剂有限公司;N,N-二异丙基乙胺:纯度98%,安耐吉化学有限公司;乙腈、乙酸:分析纯,上海凌风化学试剂有限公司;硅胶(50~75μm)、无水硫酸镁:分析纯,国药集团化学试剂有限公司;氘代试剂:分析纯,百灵威科技有限公司;石油醚、乙酸乙酯:分析纯,苏州晶协化学有限公司;N,N-二甲基甲酰胺(DMF):分析纯,使用前经干燥、减压蒸馏处理。
1.1.2 仪器核磁共振氢谱和碳谱(1H-NMR, 13C-NMR):采用美国Bruker公司的核磁共振仪(BRUKER BIOSPIN AG, Magnet System 400 MHz),测试所用溶剂为氘代氯仿(CDCl3)或者氘代DMF(DMF-d7)。
色谱-质谱联用:采用英国Micromass LCTTM型液相色谱-飞行时间质谱联用仪,配以Waters 600液相色谱仪进样系统,离子化方式为电喷雾电离(ESI)。
凝胶渗透色谱(GPC):采用美国Waters公司1515型凝胶色谱仪,装配系列聚苯乙烯色谱柱带有示差折光检测器(Wyatt Technology Corp., Optilab REX),折光指数差为-0.004 7~0.004 7,以DMF作淋洗剂,流速为1.0 mL/min,测试温度为45 ℃。
动态激光光散射(DLS):采用Zetasizer Nano (Malvern, UK,25 ℃)测量样品在DMF中的流体力学直径。
傅里叶变换红外光谱(FT-IR):采用美国Thermo Nicolet公司Nicolet 5700傅里叶变换红外光谱仪,通过KBr压片法以及涂膜法制样,测定透射光谱。
差示扫描量热分析(DSC):采用德国微分扫描量热分析仪Pyris钻石热分析工作站进行检测,装配有822e DSC模块模型,氮气气氛下,检测温度为室温~250 ℃,升温速率为10 ℃/min。
紫外-可见光光谱(UV-Vis):采用日本Shimadzu公司UV-2550紫外-可见光分光光度计。
荧光发射光谱:采用法国Fluorolog-3-P型分子荧光光谱仪测得。
1.2 AB2单体的合成AB2型单体的合成路线如图 1所示。1-苯乙炔基-3, 4-二氯-1H-吡咯-2, 5-二酮(a1)的合成:将称量好的二氯马来酸酐(2.85 g, 17.1 mmol)和醋酸钾(0.84 g, 8.5 mmol)加入带有搅拌子100 mL的茄型烧瓶中,随后加入30 mL冰醋酸充分搅拌溶解,加入对氨基苯乙炔(0.5 g, 4.3 mmol),溶液由透明变成黄色。待药品完全溶解后将整个反应体系移入120 ℃油浴搅拌器中反应10 h,随着反应的进行,反应体系颜色逐渐加深由黄色变成褐色。反应结束后,体系冷却到一定温度后真空减压蒸馏除去冰醋酸,将剩余黑色固体用乙酸乙酯和饱和氯化钠溶液分液萃取3次,乙酸乙酯相用无水硫酸镁干燥后过滤,将溶剂旋干后制成干粉,干法上样,进行柱层析硅胶柱分离提纯,以石油醚-乙酸乙酯(体积比为10: 1)为淋洗剂洗脱,得到白色粉末固体0.5 g,产率为43.6%。1H-NMR (CDCl3, 400 MHz): 7.28~7.53 (d, Ph-H, 4H), 3.07 (s, Ph-C≡CH, 1H)。13C-NMR (CDCl3, 100 MHz): 161.3, 133.7, 133.2, 130.8, 127.4, 125.5, 122.4。HRMS (EI): C12H5Cl2NO2的m/z理论值为264.969 5,实测值为264.969 7。
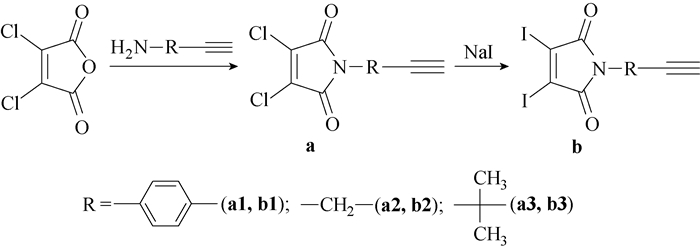
|
图 1 AB2型单体的合成路线 Fig. 1 Synthesis route of AB2 type monomers |
按上述a1的制备方法可以成功得到a2和a3。
1-丙炔基-3, 4-二氯-1H-吡咯-2, 5-二酮(a2),1H-NMR (CDCl3, 400 MHz): 4.36 (d, —CH2—, 2H), 2.26~2.28 (t, J=2.4Hz, CH2—C≡C—H, 1H)。13C-NMR (CDCl3, 100 MHz): 161.7, 133.8, 75.9, 72.6, 28.2。HRMS (EI): C7H3Cl2NO2的m/z理论值为202.954 1,实测值为202.954 6。
1-(2, 2-二甲基)丙炔基-3, 4-二氯-1H-吡咯-2, 5-二酮(a3), 1H-NMR (CDCl3, 400 MHz): 2.48 (s, —C—C≡CH, 1H),1.86 (s, CH3—C—, 6H)。13C-NMR (CDCl3, 100 MHz): 165.5, 118.1, 84.7, 71.7, 53.8, 29.2。
1-苯乙炔基-3, 4-二碘-1H-吡咯-2, 5-二酮(b1)的合成:在装有搅拌子的100 mL圆底烧瓶中加入称量好的1-苯乙炔基-3, 4-二氯-1H-吡咯-2, 5-二酮(0.5 g, 1.9 mmol),用10 mL乙腈搅拌完全溶解后,加入碘化钠(1.7 g, 11.2 mmol),全部溶解后溶液变成黄色,然后将整个反应体系置于85 ℃油浴搅拌器中,避光加热回流反应,待原料a1完全消失后停止反应,最终体系有黄色沉淀产生,低温真空旋蒸除去乙腈,将剩余橙黄色固体用乙酸乙酯和饱和氯化钠溶液分液萃取3次,有机相用无水硫酸镁干燥后过滤,将溶剂旋干后干法上样进行柱层析硅胶柱分离提纯,以石油醚-乙酸乙酯(体积比为10: 1)为淋洗剂洗脱,得到黄色粉末固体0.73 g,产率为86.5%。1H-NMR (CDCl3, 400 MHz): 7.31~7.59 (d, Ph-H, 4H), 3.13 (s, Ph-C≡CH, 1H)。13C-NMR (CDCl3, 100 MHz): 165.0, 133.0, 131.7, 127.3, 125.6, 122.3, 118.1。HRMS (EI): C12H5I2NO2的m/z的理论值为448.841 0,实测值为448.841 2。
按上述b1的制备方法成功得到b2和b3。
1-丙炔基-3, 4-二碘-1H-吡咯-2, 5-二酮(b2),1H-NMR (CDCl3, 400 MHz): 4.39 (d, —CH2—, 2H), 2.25~2.26 (t, J=2.6 Hz, CH2—C≡C—H, 1H)。13C-NMR (CDCl3, 100 MHz): 165.1, 117.5, 76.4, 72.4, 29.1。HRMS (EI): C7H3I2NO2的m/z理论值为386.825 3,实测值为386.825 9。
1-(2, 2-二甲基)丙炔基-3, 4-二碘-1H-吡咯-2, 5-二酮(b3),1H-NMR (CDCl3, 400 MHz): 2.49 (s, —C—C≡CH, 1H), 1.88 (s, CH3—C—, 6H)。13C-NMR (CDCl3, 100 MHz) 162.4, 133.0, 84.4, 71.8, 53.5, 29.2。HRMS (EI): C9H7I2NO2的m/z理论值为414.856 6,实测值为414.858 2。
1.3 HBEP的合成HBEP的合成路线如图 2所示。Sonogashira偶联反应是常用的制备烯二炔的反应。利用上述合成的3种带有碘和端基炔两种官能团的AB2型单体,在三苯基膦二氯化钯(Pd(PPh3)2Cl2)和碘化亚铜(CuI)的催化下,通过Sonogashira反应制备超支化聚合物,最后加入苯乙炔进行封端,从而得到一系列的超支化聚烯二炔聚合物。具体的合成路线见图 2。
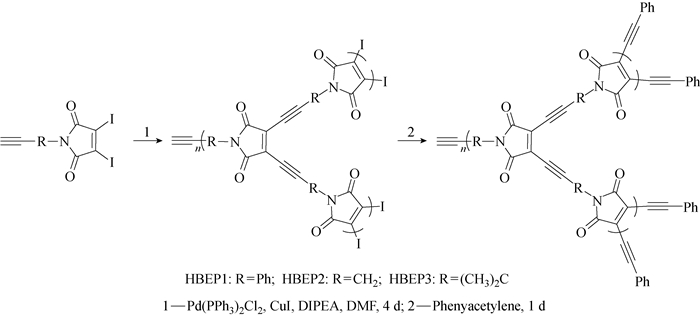
|
图 2 HBEPs的合成路线 Fig. 2 Synthesis route of HBEPs |
HBEP1的合成:在50 mL Schlenk瓶中依次加入Pd(PPh3)2Cl2(13 mg,0.018 mmol),CuI(7 mg,0.036 mmol),抽真空换氮气3次后,氮气气氛下加入5 mL DMF搅拌溶解后,加入N, N-二异丙基乙胺(73 μL,0.446 mmol),体系变成黄绿色,冻融1次后将200 mg b1用DMF溶解后加入反应瓶中,再冻融1次后,移至50 ℃油浴中室温反应4 d,加入苯乙炔反应1 d进行封端,减压蒸馏除去DMF,用1 mL THF溶解后,甲醇沉淀,离心后50 ℃真空干燥1 d,水洗除去体系中的Pd(PPh3)2Cl2和CuI,50 ℃真空干燥1 d,得到深棕色固体产物90 mg,产率约45%。
HBEP2,HBEP3,HBEP4均按上述HBEP1的合成路线制备。其中HBEP2的制备于室温下进行,HBEP4以对甲基苯乙炔作为封端剂。
2 结果与讨论 2.1 1H-NMR和支化度(DB)的计算核磁和质谱结果都证实成功得到3种AB2型单体。Sonogashira偶联聚合之后得到的聚合物(HBEPs)难以溶解在普通有机溶剂如四氢呋喃、氯仿、甲苯和二甲基砜中,这可能是由于其高分子量或强分子间相互作用。
Hawker和Frechet提出可以通过公式(1)计算DB[25]:
| $ {D_{\rm{B}}} = \frac{{D + T}}{{D + T + L}} $ | (1) |
其中:D是树枝状单元的数量,T是终端单元的数量,L是线性单元的数量。对于较高分子量的HBP,树枝状单元的数量在理论上等于终端单元数目加1。因此,Holter和Frey[26]提出了公式(1)的简化版本:
| $ {D_{\rm{B}}} = \frac{{2T}}{{2T + L}} $ | (2) |
在HBEP2和HBEP3的1H-NMR谱图中,除了来自溶剂残留物(DMF和水)的尖峰,还有2个宽峰表示芳香族质子(化学位移为6.5~8.0)和脂肪族质子(HBEP2的化学位移在4.0~5.0;HBEP3的化学位移为1.0~2.5)。其中芳香族质子仅来自末端单元的苯乙炔基,而脂肪族质子全部来自内部结构单元。因此,可以通过这2个峰的积分面积估算出T和所有结构单元(T+D+L)的数目,从而计算出这2个HBP的支化度。然而,对于HBEP1,由于末端苯基和内部亚苯基的化学位移的重叠,难以从1H-NMR谱中计算出T和L的值。为了解决这个问题,通过用对甲基苯乙炔代替HBEP1的封端基团以引入甲基来合成HBEP1的类似超支化聚合物HBEP4。如图 3所示,HBEP4末端单元中亚苯基的数目与甲基的数目一致,通过化学位移1.8~2.5处甲基的质子峰的积分面积(暂定为1)换算得到约为1/6,内部亚苯基(T+D+L)的数目也就等于总的苯基的数目减去末端亚苯基的数目约为0.35。末端单元(T)的数目通过甲基的换算约为1/12,代入方程(2)计算得到的HBEP1的DB值为0.95,几乎接近树枝状聚合物的DB值1,而HBEP2和HBEP3的DB值分别为0.86和0.62。HBEP1高支化度的原因主要是苯乙炔的反应活性比较高,而且结构简单,有利于聚合反应的持续进行。而HBEP3较低程度的支化可能是由于在主链结构中存在的两个甲基取代基,阻碍了第二碘基团的Sonogashira偶联反应,因此减慢了这些位点处的支化。
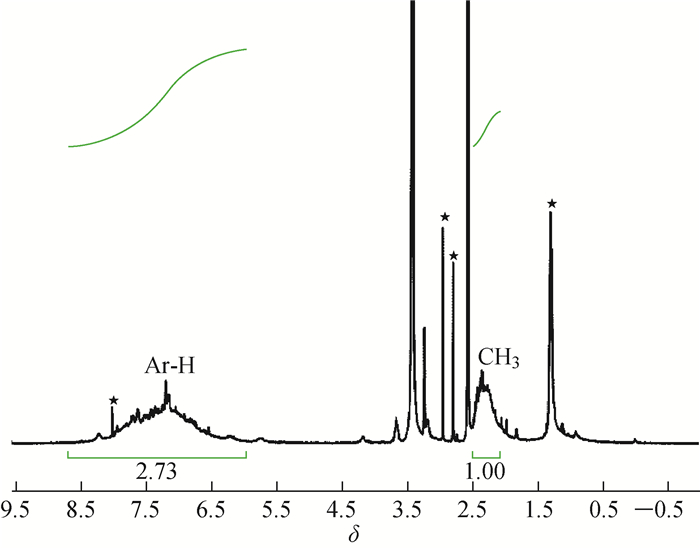
|
图 3 HBEP4的1H-NMR谱图以及用于支化度计算的积分 Fig. 3 1H-NMR spectrum of HBEP4 and integration for the calculation of DB |
图 4是HBEP1和相对应的AB2型单体b1的红外光谱图。在Sonogashira偶联聚合之后,3 290 cm-1处C≡CH的伸缩振动峰消失,而与羰基(1 720 cm-1)和C≡C(2 320 cm-1)相关联的典型吸收带保持不变或略微增强,以上结果都表明通过Sonogashira反应成功制备了超支化聚烯二炔。
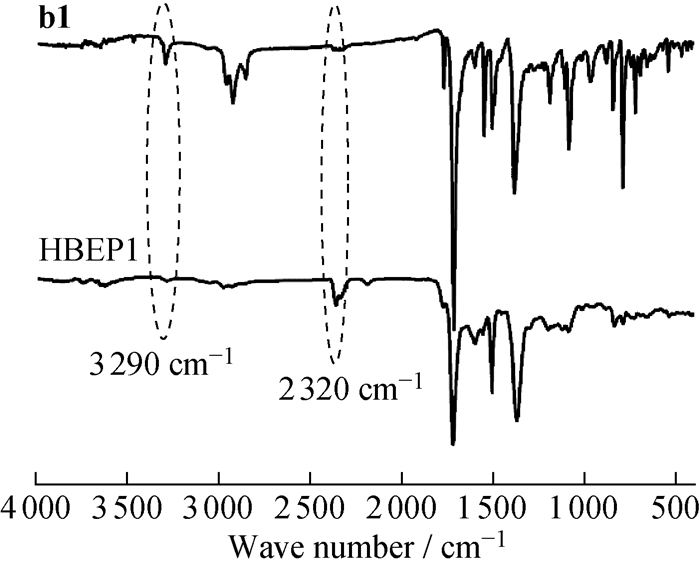
|
图 4 HBEP1和其对应单体b1的红外光谱 Fig. 4 FT-IR spectra of HBEP1 and corresponding monomer b1 |
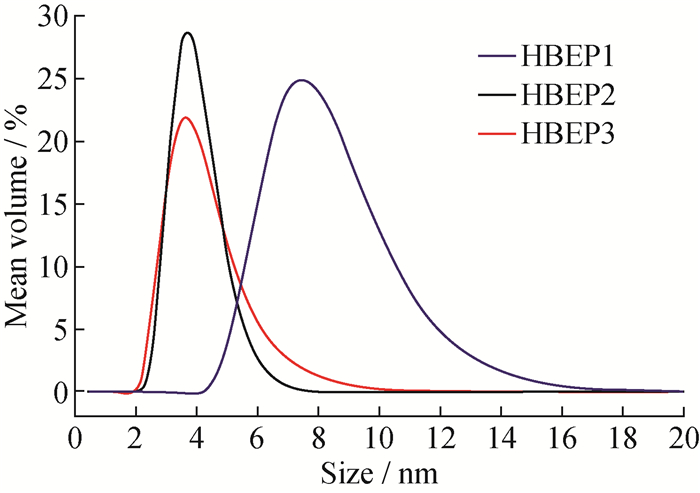
HBEPs的分子量及其分布的GPC数据总结在表 1中。聚合物的数均分子量(Mn)为9.6×103~73.5×103,PDI小于1.9。有趣的是,在相同聚合条件下,具有苯乙炔基的HBEP1的分子量远大于HBEP2和HBEP3的,这是因为苯乙炔的反应活性远高于烷基炔的。通过动态光散射测定3种聚合物的流体动力学直径,结果如图 5所示,HBEP1具有最大的流体动力学直径,与GPC测试结果一致。
|
|
表 1 HBEPs的聚合结果和表征数据 Table 1 Polymerization results and characterization data |
|
图 5 HBEPs的DLS图 Fig. 5 DLS curves of HBEPs |
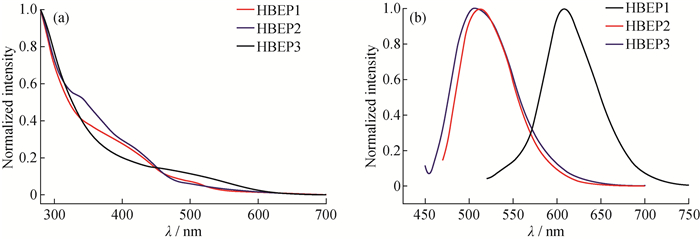
含烯二炔的HBP的紫外吸收和荧光发射特性如图 6所示, 相关的荧光参数数值见表 2。图 6(a)中所有HBEPs的紫外可见光光谱都表现出宽的吸收带,没有吸收最大值,这归因于超支化烯二炔复杂的内部结构。图 6(b)中,HBEP2和HBEP3的发射光谱在508 nm和507 nm显示最大值,最大激发波长分别在460 nm和440 nm,而HBEP1的最大激发波长和最大发射波长分别为510 nm和609 nm,这充分证实了HBEP1中存在高度共轭的烯二炔体系。用罗丹明B作为标准计算出HBEP1~HBEP3的荧光量子产率分别为0.03, 0.11和0.04。
|
图 6 HBEPs在DMF溶液中的紫外-可见光谱(a)和荧光发射光谱(b) Fig. 6 UV-Vis spectra (a) and fluorescence spectra (b) of HBEPs in DMF solutions |
|
|
表 2 HBEPs的荧光参数 Table 2 Fluorescence parameters of HBEPs |
3 结论
采用一锅法由AB2型单体通过Sonogashira交叉偶联反应,并用苯基乙炔封端合成了3种具有烯二炔结构单元的荧光超支化聚合物HBEP1~HBEP3。其中基于苯乙炔的HBEP1的数均分子量高达73.5×103,支化度接近于1。不同共轭程度的HBEPs表现出了不同的紫外吸收和荧光特性。
| [1] | ZHENG Y, LI S, GAO C, et al. Hyperbranched polymers:Advances from synthesis to applications[J]. Chemical Society Reviews, 2015, 44(12): 4091–4130. DOI:10.1039/C4CS00528G |
| [2] | WU W, TANG R, LI Q, et al. Functional hyperbranched polymers with advanced optical, electrical and magnetic properties[J]. Chemical Society Reviews, 2015, 44(12): 3997–4022. DOI:10.1039/C4CS00224E |
| [3] | LIU G, ZHANG G, HU J, et al. Hyperbranched self-immolative polymers (hSIPs) for programmed payload delivery and ultrasensitive detection[J]. Journal of the American Chemical Society, 2015, 137(36): 11645–11655. DOI:10.1021/jacs.5b05060 |
| [4] | LIU G, CHEN P, TANG R, et al. Synthesis and characterization of dendronized hyperbranched polymers through the "A3+B2" approach[J]. Science China Chemistry, 2016, 59(12): 1561–1567. DOI:10.1007/s11426-016-0250-5 |
| [5] | 王思怿, 郭旭虹, 陈凯敏. 聚合物刷与生物分子相互作用的研究进展[J]. 功能高分子学报, 2016, 29(4): 359–376. |
| [6] | KIM Y H. Hyperbranched polymers 10 years after[J]. Journal of Polymer Science Part A:Polymer Chemistry, 1998, 36(11): 1685–1698. DOI:10.1002/(ISSN)1099-0518 |
| [7] | GAO C, YAN D. Hyperbranched polymers:From synthesis to applications[J]. Progress in Polymer Science, 2004, 29(3): 183–275. DOI:10.1016/j.progpolymsci.2003.12.002 |
| [8] | GILLIES E, FRECHET J. Dendrimers and dendritic polymers in drug delivery[J]. Drug Discovery Today, 2005, 10(1): 35–43. DOI:10.1016/S1359-6446(04)03276-3 |
| [9] | CAO X, SHI Y, WANG X, et al. Design a highly reactive trifunctional core molecule to obtain hyperbranched polymers with over a million molecular weight in one-pot click polymerization[J]. Macromolecules, 2016, 49(3): 760–766. DOI:10.1021/acs.macromol.5b02678 |
| [10] | DURO-CASTANO A, MOVELLAN J, VICENT M J. Smart branched polymer drug conjugates as nano-sized drug delivery systems[J]. Biomaterials Science, 2015, 3(10): 1321–1334. DOI:10.1039/C5BM00166H |
| [11] | HÄUBLER M, LAM J W Y, ZHENG R, et al. Hyperbranched polyarylenes[J]. Comptes Rendus Chimie, 2003, 6(8-10): 833–842. DOI:10.1016/j.crci.2003.06.003 |
| [12] | LI Z A, WU W, YE C, et al. New second-order nonlinear optical polymers derived from AB2 and AB monomers via sonogashira coupling reaction[J]. Macromolecular Chemistry and Physics, 2010, 211(8): 916–923. DOI:10.1002/macp.200900605 |
| [13] | PÖTZSCH R, KOMBER H, STAHL B C, et al. Radical thiol-yne chemistry on diphenylacetylene:Selective and quantitative addition enabling the synthesis of hyperbranched poly(vinyl sulfide)s[J]. Macromolecular Rapid Communications, 2013, 34(22): 1772–1778. DOI:10.1002/marc.v34.22 |
| [14] | ZHAO B, ZHENG Y, WENG Z, et al. The electrophilic effect of thiol groups on thiol-yne thermal click polymerization for hyperbranched polythioether[J]. Polym Chem, 2015, 6(20): 3747–3753. DOI:10.1039/C5PY00307E |
| [15] | LUO L, QIU T, MENG Y, et al. A novel fluoro-terminated hyperbranched poly(phenylene oxide) (FHPPO):Synthesis, characterization, and application in low-k epoxy materials[J]. RSC Advances, 2013, 3(34): 14509–14520. DOI:10.1039/c3ra40721g |
| [16] | JIANG Y, WANG Y, YANG J, et al. Synthesis, two-photon absorption, and optical power limiting of new linear and hyperbranched conjugated polyynes based on bithiazole and triphenylamine[J]. Journal of Polymer Science Part A:Polymer Chemistry, 2011, 49(7): 1830–1839. |
| [17] | SEN C P, DEVENDAR GOUD V, SHRESTHA R G, et al. Bodipy based hyperbranched conjugated polymers for detecting organic vapors[J]. Polym Chem, 2016, 7(25): 4213–4225. DOI:10.1039/C6PY00847J |
| [18] | WU W, YE C, QIN J, et al. The utilization of isolation chromophore in an "A3+B2" type second-order nonlinear optical hyperbranched polymer[J]. Macromolecular Rapid Communications, 2013, 34(13): 1072–1079. DOI:10.1002/marc.v34.13 |
| [19] | 王婷, 易成林, 刘晓亚, 等. 支化型交替聚(苯乙烯-alt-马来酸酐)自组装胶束的制备及其乳化性能[J]. 功能高分子学报, 2014, 27(2): 164–171. |
| [20] | LAI N, ZHANG Y, ZENG F, et al. Effect of degree of branching on the mechanism of hyperbranched polymer to establish the residual resistance factor in high-permeability porous media[J]. Energy & Fuels, 2016, 30(7): 5576–5584. |
| [21] | COOK A B, BARBEY R, BURNS J A, et al. Hyperbranched polymers with high degrees of branching and low dispersity values:Pushing the limits of thiol-yne chemistry[J]. Macromolecules, 2016, 49(4): 1296–1304. DOI:10.1021/acs.macromol.6b00132 |
| [22] | BERGMAN R G. Reactive 1, 4-dehydroaromatics[J]. Accounts of Chemical Research, 1973, 6(1): 25–31. DOI:10.1021/ar50061a004 |
| [23] | KAR M, BASAK A. Design, synthesis, and biological activity of unnatural enediynes and related analogues equipped with pH-dependent or phototriggering devices[J]. Chemical Reviews, 2007, 107(7): 2861–2890. DOI:10.1021/cr068399i |
| [24] | CHEN S, HU A. Recent advances of the Bergman cyclization in polymer science[J]. Science China Chemistry, 2015, 58(11): 1710–1723. DOI:10.1007/s11426-015-5460-4 |
| [25] | HAWKER C J, LEE R, FRECHET J M J. One-step synthesis of hyperbranched dendritic polyesters[J]. Journal of the American Chemical Society, 1991, 113(12): 4583–4588. DOI:10.1021/ja00012a030 |
| [26] | HÖLTER D, BURGATH A, FREY H. Degree of branching in hyperbranched polymers[J]. Acta Polymerica, 1997, 48(1-2): 30–35. |
 2017, Vol. 30
2017, Vol. 30


